Стереотаксическая биопсия опухолей головного мозга с планированием в условиях магнитно-резонансной томографии
РМЖ. №16 от 07.09.2017 стр. 1194-1199
Рубрика:
Онкология
В настоящее время стереотаксическая биопсия является широко распространенным минимально инвазивным вмешательством в нейрохирургической практике. Она выполняется при патологических объемных образованиях труднодоступной для открытых хирургических вмешательств локализации или в случае высокого риска осложнений при проведении анестезиологического пособия. Гистологический диагноз имеет решающее значение для построения правильного плана лечения (лучевой терапии, химиотерапии) и определения прогноза заболевания. Успех стереотаксической биопсии зависит от рабочего состояния стереотаксической аппаратуры, современного специализированного программного обеспечения для определения координат мишени и тщательного пошагового выполнения алгоритма проведения данной манипуляции. В работе подробно описываются показания к стереотаксической биопсии, техника ее выполнения и факторы влияющие на успех исследования. Приводятся клинические примеры больных, обследованных и оперированных в МИБС, с различными патологическими процессами головного мозга. Анализ проделанной работы показал, что стереотаксическая биопсия патологических образований головного мозга является безопасным и эффективным методом диагностики. Полученные данные соответствуют данным крупных нейрохирургических центров. Диагностическая достоверность стереотаксической биопсии составляет 93‒96%.
Ключевые слова: стереотаксическая биопсия, стереотаксическая биопсия опухолей головного мозга, опухоль головного мозга, энцефалит, первичная лимфома ЦНС, радионекроз, стереотаксическая система Leksell Stereotactic System®, иммуногистохимическое исследование, техника выполнения биопсии головного мозга.
Для цитирования: Щербань А.Е., Иванов П.И., Черкашин М.А., Желбунова Е.А. Стереотаксическая биопсия опухолей головного мозга с планированием в условиях магнитно-резонансной томографии. РМЖ. Медицинское обозрение. 2017;25(16):1194-1199.
Ключевые слова: стереотаксическая биопсия, стереотаксическая биопсия опухолей головного мозга, опухоль головного мозга, энцефалит, первичная лимфома ЦНС, радионекроз, стереотаксическая система Leksell Stereotactic System®, иммуногистохимическое исследование, техника выполнения биопсии головного мозга.
Для цитирования: Щербань А.Е., Иванов П.И., Черкашин М.А., Желбунова Е.А. Стереотаксическая биопсия опухолей головного мозга с планированием в условиях магнитно-резонансной томографии. РМЖ. Медицинское обозрение. 2017;25(16):1194-1199.
Stereotactic biopsy of brain tumors with MRI planning
ShcherbanA.E., Ivanov P.I., Cherkashin M.A., Zhelbunova E.A.
Medical and Diagnostic Center of International Institute of Biological Systems named after Berezin Sergei, St. Petersburg
Currently, stereotactic biopsy is a widespread minimally invasive intervention in neurosurgical practice. It is performed in pathological voluminous formations inaccessible for open surgical interventions or in the case of a high risk of complications during anesthesia.
Histological diagnosis is crucial for building the right treatment plan (radiation therapy, chemotherapy) and determining the prognosis of the disease. The success of the stereotactic biopsy depends on the state of the stereotaxic apparatus, the modern specialized software for determining the coordinates of the target and the careful step-by-step execution of the algorithm for performing this manipulation.
The work describes in detail the indications for a stereotactic biopsy, the technique of its implementation, and the factors that influence the success of the study. Clinical examples of patients, examined and operated in MIBS, with various pathological processes of the brain are presented.
An analysis of the work has shown that stereotactic biopsy of pathological formations of the brain is a safe and effective method of diagnosis.
The data obtained correspond to the data of large neurosurgical centers. The diagnostic reliability of a stereotactic biopsy is 93-96%.
Key words: stereotactic biopsy, stereotaxic biopsy of brain tumors, brain tumor, encephalitis, primary CNS lymphoma, radio necrosis, Leksell Stereotactic System®, immunohistochemical study, brain biopsy technique.
For citation: ShcherbanA.E., Ivanov P.I., Cherkashin M.A., Zhelbunova E.A. Stereotactic biopsy of brain tumors with MRI planning // RMJ. 2017. № 16. P. 1194–1199.
ShcherbanA.E., Ivanov P.I., Cherkashin M.A., Zhelbunova E.A.
Medical and Diagnostic Center of International Institute of Biological Systems named after Berezin Sergei, St. Petersburg
Currently, stereotactic biopsy is a widespread minimally invasive intervention in neurosurgical practice. It is performed in pathological voluminous formations inaccessible for open surgical interventions or in the case of a high risk of complications during anesthesia.
Histological diagnosis is crucial for building the right treatment plan (radiation therapy, chemotherapy) and determining the prognosis of the disease. The success of the stereotactic biopsy depends on the state of the stereotaxic apparatus, the modern specialized software for determining the coordinates of the target and the careful step-by-step execution of the algorithm for performing this manipulation.
The work describes in detail the indications for a stereotactic biopsy, the technique of its implementation, and the factors that influence the success of the study. Clinical examples of patients, examined and operated in MIBS, with various pathological processes of the brain are presented.
An analysis of the work has shown that stereotactic biopsy of pathological formations of the brain is a safe and effective method of diagnosis.
The data obtained correspond to the data of large neurosurgical centers. The diagnostic reliability of a stereotactic biopsy is 93-96%.
Key words: stereotactic biopsy, stereotaxic biopsy of brain tumors, brain tumor, encephalitis, primary CNS lymphoma, radio necrosis, Leksell Stereotactic System®, immunohistochemical study, brain biopsy technique.
For citation: ShcherbanA.E., Ivanov P.I., Cherkashin M.A., Zhelbunova E.A. Stereotactic biopsy of brain tumors with MRI planning // RMJ. 2017. № 16. P. 1194–1199.
Статья посвящена возможностям стереотаксической биопсии опухолей головного мозга с планированием в условиях магнитно-резонансной томографии
Введение
Стереотаксическая биопсия новообразований головного мозга представляет собой минимально инвазивную процедуру, позволяющую получить образцы патологической ткани мозга для проведения прижизненного патоморфологического исследования. Целью проведения этой процедуры является постановка окончательного диагноза. Стереотаксическая биопсия выполняется при патологических объемных образованиях труднодоступной для открытых хирургических вмешательств локализации или в случае высокого риска осложнений при проведении анестезиологического пособия.Учитывая особенности строения центральной нервной системы и требования предельной осторожности в нейрохирургической практике, еще в конце 1940-х годов остро встал вопрос о необходимости проведения минимально инвазивных методик при нейрохирургических вмешательствах. Шпигель (Spiegel) и Викс (Wycis) разработали стереотаксический аппарат, который впоследствии был усовершенствован Ларсом Лекселлом (Lars Leksell). В 1949 г. Лекселл сообщил о первом «легком в обращении и практичном в рутинной клинической работе» стереотаксическом аппарате [1, 2].
Простота использования и практичность были основными принципами всех последующих систем Лекселла [2]. С появлением ангиографии, рентгена, компьютерной томографии, магнитно-резонансной томографии (МРТ), позитронно-эмиссионной томографии (ПЭТ) совершенствовалась методика предоперационного планирования. В результате расширялись показания и возможности для проведения стереотаксической биопсии.
Материал и методы
В нашей клинике биопсия образований головного мозга выполняется при помощи стереотаксической системы (Leksell Stereotactic System®, Швеция) с трехмерной ориентацией в пространстве, основанной на координирующей раме (Leksell® Coordinate Frame, Швеция). Данная система удобна в обращении, имеет высокую точность и совместима со всеми современными методами нейровизуализации. В основе метода используется принцип «центра дуги», разработанный Ларсом Лекселлом [2]. Метод обеспечивает полную доступность к внутричерепным образованиям с возможностью выбора безопасной траектории и точки входа.Держатель инструмента перемещается по дуге. Радиус дуги равен 190 мм. Целевая точка рассчитывается в декартовой системе координат. Принцип работы системы: цель всегда находится точно в центре стереотаксической дуги.
Основой стереотаксической системы является координирующая рама (Leksell® Coordinate Frame G) ‒ это алюминиевая конструкция, состоящая из прямоугольного основания 190×210 мм (рис. 1).

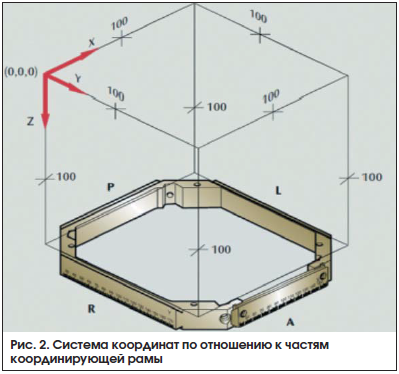
Для получения возможности точного позиционирования в координирующую раму встроена прямолинейная шкала координат. Начало координат Leksell® Coordinate System (где X, Y и Z равны нулю) расположено за пределами координирующей рамы в точке, которая является верхней, латеральной и задней по отношению к координирующей раме справа от пациента (рис. 2) [2].
Алгоритм выполнения стереотаксической биопсии включает 5 этапов.
1-й этап ‒ фиксация стереотаксической рамы. Координирующая (стереотаксическая) рама Лекселла(Leksell® Coordinate Frame G, Швеция) фиксируется винтами к голове пациента под местной анестезией. При этом всегда следует учитывать анатомические особенности пациента (короткая шея, грудной кифоз и т. д.). Рама не должна быть фиксирована слишком низко ввиду того, что: а) необходимо место для фиксации к раме стереотаксической системы с держателем иглы; б) низкая фиксация может затруднять проведение интубации в случае необходимости.
Фиксация стоек стереотаксической рамы не должна быть ниже большого затылочного бугра из-за риска перелома основания черепа. Слишком высокое расположение фиксирующих стоек может привести к неустойчивой фиксации и даже соскальзыванию с повреждением скальпа. Фиксирующие стойки также не должны быть плотно прижаты к прилежащим скуловой, щечной областям из-за риска некроза. При затягивании винтов следует избегать чрезмерных усилий, т. к. это может привести к деформации стоек и смещению координат объекта, выбранного для взятия биопсии. Винты должны быть вкручены до кости.
2-й этап ‒ стереотаксическая магнитно-резонанснаятомография. Планирование биопсии в нашем центре проводится по данным МРТ головного мозга с внутривенным контрастированием. На координирующую раму фиксируется локалайзер (рис. 3).

Это устройство представляет собой три пластиковые пластины с N-образной системой каналов, заполненных медным купоросом. При МР-сканировании медный купорос образует систему меток, по расположению которых программа планирования (Surgi Plan®, Швеция) определяет положение целевых точек в декартовой системе координат рамы, т. е. обеспечивает привязку топографических координат к координатам рамы, а через раму ‒ к центру дуги стереотаксической системы. При дефайне (от англ. define – определять), т. е. привязке томографических координат к координатам стереотаксической системы, потеря точности составляет в среднем 0,5 мм.
Выполнение МРТ с внутривенным контрастированием повышает информативность нейровизуализации при проведении биопсии. При планировании стереотаксической биопсии используется тонкосрезовое сканирование в следующих МР-последовательностях: T1 до и после внутривенного контрастирования (толщина срезов 1 мм), T2 (толщина срезов 2,5 мм), T2-FLAIR (иногда требуется оценка после внутривенного контрастирования), TOF (для оценки артериальных и венозных сосудов), CISS. В некоторых случаях для планирования используется мультиспиральная компьютерная томография (МСКТ). При МСКТ используется локалайзер с N-образной системой медных полосок (рис. 4). При необходимости выполняется корегистрация с данными ранее выполненной ПЭТ головного мозга с C-11-метионином.

3 этап ‒ планирование процедуры стереотаксической биопсии. Предоперационное планирование для каждого пациента выполняется индивидуально и зависит от анатомических особенностей, размеров, формы и локализации цели. Как правило, выбирается самое короткое расстояние от точки входа (Entry point) до целевой точки (Target), минуя крупные сосуды, функционально значимые зоны головного мозга. Для определения целевой точки в трехмерном пространстве головного мозга используются математические расчеты в программе Leksell Surgi Plan®.
4-й этап ‒ установка заданных координат. Результатом планирования является определение координат X, Y, Z (точки входа, целевой точки), углов на дуге с учетом выбранной стороны и кольце стереотаксической системы и дистанции между точкой входа и заданной целью. По полученным координатам на координирующей раме последовательно собирается стереотаксическая система (рис. 5).

5-й этап ‒ проведение биопсии. Как правило, биопсия выполняется под местной анестезией. После установки заданных координат на стереотаксической системе (Leksell Stereotactic System®, Швеция) из планирующей программы (Leksell SurgiPlan®, Швеция) выполняется кожный разрез, накладывается фрезевое отверстие, выполняется разрез твердой мозговой оболочки. Устанавливается стереотаксическая дуга с заданными координатами. Затем последовательно, по ходу траектории пункционной иглы выполняется 2‒3 биопсии образования на разной глубине: проксимально, в целевой точке и дистально от нее. Для взятия биопсии мы чаще используем одноразовую иглу (Sedan Biopsy Needle, Швеция), которая имеет боковое окно длиной 10 мм и шириной 2,5 мм, с режущим механизмом (рис. 6).

Аспирация осуществляется шприцем Люэра (Luer) 10 или 20 мл через переходную аспирационную трубку. Игла имеет наружную и внутреннюю канюли (рис. 6а). При введении биопсийной иглы в мозг внутренняя канюля должна быть полностью вставлена во внешнюю таким образом, чтобы боковое режущее окно иглы было полностью закрыто. Игла вращательными движениями аккуратно и медленно погружается на заданную в соответствии с координатами глубину. Ориентируясь на маркировку проксимальной части канюли, внутренняя канюля поворачивается относительно наружной на 180°. При этом боковое окно полностью открыто и система готова для взятия биопсии (рис. 6б). К проксимальной канюле напрямую или через трубку присоединяют шприц 10‒20 мл, при помощи которого вручную создается вакуум и проводится аспирация. Количество материала будет зависеть от степени созданного в канюле разряжения, которое можно изменять в зависимости от плотности биопсируемой ткани. Продолжая аспирацию, внутреннюю канюлю поворачивают относительно неподвижной наружной на 180°, при этом боковое окно полностью закрывается (рис. 6в). Аспирация шприцем прекращается. Наружная канюля в неподвижном положении удерживается в мозге, а внутренняя канюля извлекается из внешней. Затем полученный материал извлекается из внутренней канюли (с помощью введенных в нее нескольких миллилитров воздуха или физиологического раствора), фиксируется в буферном растворе формалина и направляется для проведения патоморфологического исследования. Для взятия материала на более глубоком уровне держатель иглы опускают на заданный уровень, внутреннюю канюлю с закрытым боковым окном погружают в наружную до упора на держателе иглы. После успешного получения материала, внутренняя канюля вставляется во внешнюю при закрытом боковом режущем окне, и обе одновременно извлекаются.
На следующей день после проведенной биопсии выполняется контрольная МСКТ головного мозга для исключения возможного послеоперационного кровотечения с образованием внутричерепной гематомы. Как правило, больные выписываются уже через 24 часа после выполненной процедуры.
В отделении патоморфологии биопсийный материал предварительно окрашивается гематоксилином и эозином, затем проводится иммуногистохимическое исследование.
Клинические наблюдения
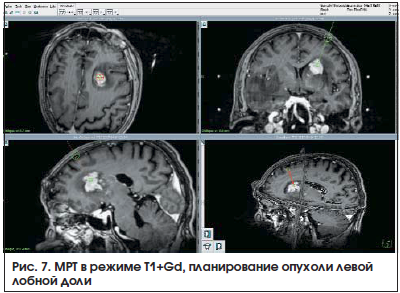
1. Первичная лимфома ЦНСПациент Ш., 63 года. МРТ: признаки множественных новообразований головного мозга. Выполнено планирование стереотаксической биопсии опухоли левой лобной доли (рис. 7).
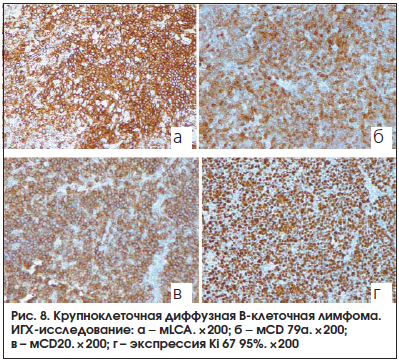
Иммунофенотип опухоли соответствует диффузной крупноклеточной B-клеточной лимфоме. Результат иммуногистохимического исследования (рис. 8): выявлена мембранная экспрессия общего лейкоцитарного антигена (LCA) в клетках опухоли (рис. 8а), цитоплазматическая и мембранная экспрессия СD 79a в клетках опухоли (рис. 8б), мембранная экспрессия СD 20 в клетках опухоли (рис. 8в). Выявляется ядерная экспрессия Ki67 95% (рис. 8г).
Пациент У., 51 год. МРТ: признаки объемного образования передних отделов мозолистого тела с двусторонним распространением (рис. 9).
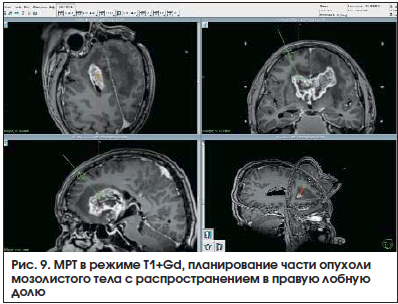
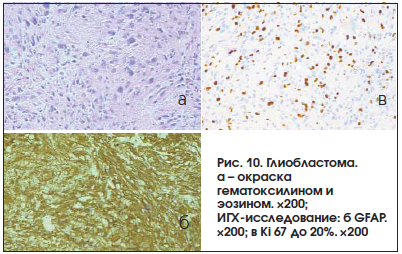
Выполнено планирование стереотаксической биопсии части опухоли, распространяющейся в правую лобную долю. Патоморфологическое заключение: глиобластома (GIV) (рис.10). При окрашивании гематоксилином и эозином (рис. 10а) признаки анаплазии нейроэктодермальной опухоли с выраженным ядерным и клеточным полиморфизмом, пролиферацией сосудов и их эндотелия. Результат иммуногистохимического исследования: выявлена экспрессия GFRP (глиального фибриллярного кислого белка) (рис. 10б), экспрессия Ki67 до 20% (рис. 10 в).
3.Фибриллярно-протоплазматическая астроцитома
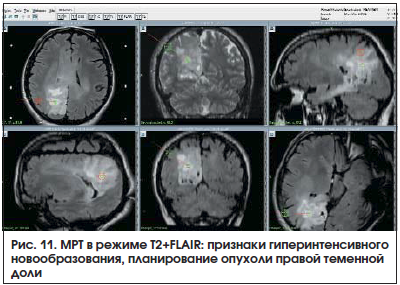
Пациент Л., 41 год. МРТ: признаки объемного образования правой теменной доли, гиперинтенсивного роста на T2-FLAIR-изображении (рис. 11).
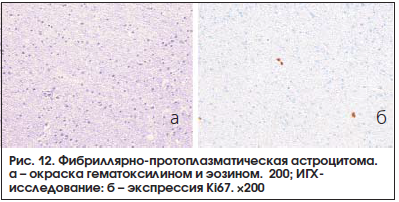
Выполнено планирование стереотаксической биопсии опухоли правой теменной доли. Патоморфологическое заключение: фибриллярно-протоплазматическая астроцитома (GII) (рис.12). При окрашивании гематоксилином и эозином признаки диффузной мелкокистозной глиальной опухоли (рис. 12а), с минимальной пролиферативной активностью Ki67 до 2‒3% (рис. 12б).
4. Васкулит и энцефалит
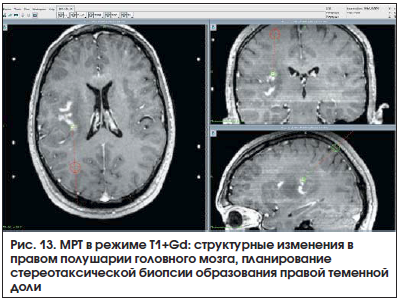
Пациент П., 25 лет. МРТ: признаки структурных изменений в правом полушарии головного мозга. Проводился дифференциальный диагноз с неопухолевым поражением головного мозга. Выполнено планирование стереотаксической биопсии образования правой теменной доли (рис. 13).
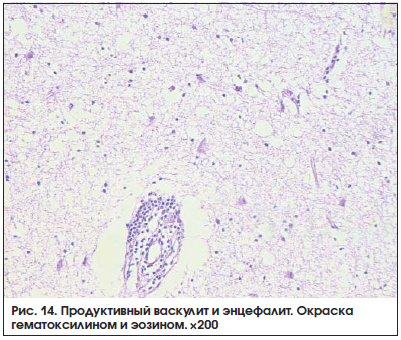
При морфологическом исследовании: выявляется разряженность нейропиля с перицеллюлярным отеком и фокусом лимфоидной инфильтрации вокруг мелких сосудов (рис. 14). Ретроспективно, после дообследования у инфекциониста диагностирована хроническая герпетическая инфекция.
Обсуждение
В настоящее время стереотаксическая биопсия является широко распространенным минимально инвазивным вмешательством в нейрохирургической практике. Техника ее постоянно совершенствуется. Морфологическая верификация биопсируемого патологического образования головного мозга имеет решающее значение для определения тактики лечения пациента. Знание гистологического диагноза необходимо для построения правильного плана лечения пациентов с опухолями головного мозга (лучевой терапии, химиотерапии) и определения прогноза заболевания. Проведение стереотаксической биопсии особенно актуально в тех случаях, когда: а) открытое оперативное вмешательство невозможно или нецелесообразно; б) новообразование локализуется в функционально значимой зоне головного мозга (двигательная, речевая часть коры, область базальных ядер, мозолистого тела, ствол головного мозга); в) имеются мультифокальное и/или диффузное поражение, подозрение на метастатический характер опухоли (это особенно важно при метастатическом поражении головного мозга без выявленного первичного очага); г) существует подозрение на первичную лимфому центральной нервной системы; д) необходимо проведение дифференциального диагноза между продолженным ростом опухоли и радионекрозом после ранее проведенной радиотерапии и/или радиохирургии опухоли; е) необходимо верифицировать инфекционные заболевания головного мозга и их последствия.Противопоказания к проведению стереотаксической биопсии:
1) нарушения коагуляции различного генеза (геморрагические диатезы, прием антикоагулянтов, антиагрегантов). Количество тромбоцитов менее 50×109/л ‒ абсолютное противопоказание. Желательно, чтобы количество тромбоцитов было более 100×109/л;2) невозможность проведения общей и местной анестезии [3].
Успешное проведение стереотаксической биопсии зависит от многих факторов. Оборудование должно быть точно откалибровано. На этапе планирования очень важно правильно интерпретировать данные методов нейровизуализации. Использование совокупности описанных выше МР-последовательностей и контрастное усиление повышают информативность полученного изображения (определение краев опухоли, зоны некроза, перифокального отека, кистозного, солидного компонентов образования). МСКТ позволяет выполнить четкую привязку к костным ориентирам. При этом очень важно учитывать возможную гетерогенность патоморфологической структуры опухоли, когда чередуются участки опухоли доброкачественного и злокачественного строения (например, участки глиальной опухоли, соответствующие GIII-GIV или GII-GIII) [4]. Не рекомендуется для биопсии выбирать образования небольших размеров ввиду риска их смещения. Количество материала должно быть достаточным для проведения морфологического (гистологического, иммуногистохимического) и молекулярно-генетического исследований. Для этого в нашей клинике биопсия выполняется в 2‒3-х точках. Не стоит стремиться брать материал из центра опухоли, где чаще локализуется зона некроза. При этом взятие материала по периферии повышает риск получения материала в виде неизмененного вещества головного мозга. В свою очередь, взятие материала из периферической зоны при опухолях пинеальной области недопустимо из-за опасности повреждения окружающих опухоль сосудов. Поэтому при взятии материала из опухоли пинеальной области режущее боковое окно иглы должно полностью находиться в паренхиме опухоли [5]. При подозрении на лимфому до проведения биопсии следует избегать назначения глюкокортикостероидов. Биопсия при этой патологии является методом выбора, т. к. резекция опухоли не улучшает прогноз заболевания и может быть оправдана только при угрожающем жизни дислокационном синдроме.
Очень важным является сотрудничество нейрохирурга и патологоанатома. Необходимо точно указывать анатомическую локализацию точки взятия биопсии в головном мозге, клинико-диагностические данные во избежание возможных ошибок при верификации опухоли.
Осложнения стереотаксической биопсии встречаются редко. К ним относятся внутричерепные кровотечения и/или инфекционные осложнения, преходящий или постоянный неврологический дефицит. Чаще встречаются кровоизлияния, хотя в большинстве случаев они незначительны и не имеют кинических проявлений [1‒3].
При злокачественных новообразованиях (глиобластома, лимфома) риск кровоизлияний возрастает. По литературным данным, уровень смертности при биопсии супратенториальной локализации составляет менее 1% и при опухолях ствола ‒ примерно 4%. Это позволяет отнести стереотаксическую биопсию новообразований головного мозга к безопасной процедуре с диагностической достоверностью 93‒96%, по данным крупных нейрохирургических центров [1‒4].
Выводы:
1) биопсия является безопасным и эффективным методом дифференциальной диагностики патологических новообразований различной этиологии;2) позволяет более точно определить тактику лечения пациента в зависимости от результатов морфологического исследования;
3) является обязательной диагностической процедурой при подозрении на онкологическое заболевание в случае, когда открытое оперативное вмешательство невозможно.
Литература
1. Christianto B. Lumenta, Concezio Di Rocco, Jens Haase, Jan Jakob A. Mooij (edits.). Neurosurgery (European Manual of Medicine). Springer ‒ Verlag, Berlin, Heidelberg, 2010. 660 p.
2. Andres M. Lozano, Philip L. Gildenberg. Ronald R. Tasker. Textbook of Stereotactic and Functional Neurosurgery.Vol. 1 Springer – Verlag, Berlin, Heidelberg 2009. 3288 p.
3. Handbook Neurosurgery Mark S. Greenberg 2016. Thieme, N.Y. 1661 p.
4. Мацко Д.Е., Нейрохирургическая патология. Руководство. СПб: ФГБУ «РНХИ им. проф. А.Л. Поленова», 2015. 424 с. [Macko D.E., Nejrohirurgicheskaja patologija. Rukovodstvo. SPb: FGBU «RNHI im. prof. A.L. Polenova», 2015. 424 s. (in Russian)].
5. Коновалов А.Н., Пицхелаури Д.И. Лечение опухолей пинеальной области. Монография. М.: Можайский полиграф. комбинат, 2004. 280 с. [Konovalov A.N., Pichelauri D.I. Lechenie opuholej pineal'noj oblasti. Monografija. M.: Mozhajskij poligraf. kombinat, 2004. 280 s. (in Russian)].
2. Andres M. Lozano, Philip L. Gildenberg. Ronald R. Tasker. Textbook of Stereotactic and Functional Neurosurgery.Vol. 1 Springer – Verlag, Berlin, Heidelberg 2009. 3288 p.
3. Handbook Neurosurgery Mark S. Greenberg 2016. Thieme, N.Y. 1661 p.
4. Мацко Д.Е., Нейрохирургическая патология. Руководство. СПб: ФГБУ «РНХИ им. проф. А.Л. Поленова», 2015. 424 с. [Macko D.E., Nejrohirurgicheskaja patologija. Rukovodstvo. SPb: FGBU «RNHI im. prof. A.L. Polenova», 2015. 424 s. (in Russian)].
5. Коновалов А.Н., Пицхелаури Д.И. Лечение опухолей пинеальной области. Монография. М.: Можайский полиграф. комбинат, 2004. 280 с. [Konovalov A.N., Pichelauri D.I. Lechenie opuholej pineal'noj oblasti. Monografija. M.: Mozhajskij poligraf. kombinat, 2004. 280 s. (in Russian)].

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья