Опыт применения повторного стереотаксического облучения в режиме гипофракционирования при рецидивах рака головы и шеи
РМЖ. №16 от 07.09.2017 стр. 1190-1194
Рубрика:
Онкология
Рецидивы рака головы и шеи развиваются более чем у половины больных после агрессивного первичного лечения. Хирургический метод лечения рецидива обеспечивает наилучшие результаты, однако не всегда осуществим. В связи с этим повторное облучение при рецидивах остается актуальной проблемой современной онкологии.
Цель: изучение переносимости и непосредственной эффективности по критерию локального контроля повторной стереотаксической лучевой терапии в режиме гипофракционирования у больных с локальными и регионарными рецидивами рака головы и шеи.
Материал и методы: в исследование включены 8 пациентов с локальными и регионарными рецидивами рака головы и шеи, ранее получившие курс лучевой терапии в составе первичного лечения. Пациентам проведен повторный курс лучевой терапии в режиме гипофракционирования (35 Гр за 7 фракций). Объемы облучения формировались с использованием ПЭТ-КТ с 18F-ФДГ, МРТ и КТ. Подведение дозы осуществлялось с применением методик объемно-модулированной терапии конформными арками (VMAT) c использованием средств IGRT (ортогональные рентгеновские снимки и КТ в конусном пучке) для контроля позиционирования пациента.
Результаты: ранние лучевые реакции были выражены в виде лучевого мукозита I‒II степени, лучевого дерматита I‒II степени. Один пациент погиб из-за развития профузного кровотечения через 3 нед. после окончания лучевого лечения. Объективный ответ был достигнут у 6 из 8 пациентов. При медиане наблюдения 11 мес. не возникло развития поздних лучевых осложнений, приводящих к снижению качества жизни.
Заключение: повторная стереотаксическая лучевая терапия в режиме гипофракционирования у пациентов с локорегионарными рецидивами рака головы и шеи является хорошо переносимым видом лечения, обеспечивающим высокие показатели локального контроля с сохранением удовлетворительного качества жизни. Тем не менее риск развития фатальных постлучевых осложнений определяет необходимость тщательного отбора кандидатов для данного вида лечения.
Ключевые слова: повторное облучение, рак головы и шеи, рецидив, гипофракционирование.
Для цитирования: Михайлов А.В., Воробьев Н.А., Сокуренко В.П., Смирнова Е.В., Мартынова Н.И., Гуцало Ю.В. Опыт применения повторного стереотаксического облучения в режиме гипофракционирования при рецидивах рака головы и шеи. РМЖ. Медицинское обозрение. 2017;25(16):1190-1194.
Цель: изучение переносимости и непосредственной эффективности по критерию локального контроля повторной стереотаксической лучевой терапии в режиме гипофракционирования у больных с локальными и регионарными рецидивами рака головы и шеи.
Материал и методы: в исследование включены 8 пациентов с локальными и регионарными рецидивами рака головы и шеи, ранее получившие курс лучевой терапии в составе первичного лечения. Пациентам проведен повторный курс лучевой терапии в режиме гипофракционирования (35 Гр за 7 фракций). Объемы облучения формировались с использованием ПЭТ-КТ с 18F-ФДГ, МРТ и КТ. Подведение дозы осуществлялось с применением методик объемно-модулированной терапии конформными арками (VMAT) c использованием средств IGRT (ортогональные рентгеновские снимки и КТ в конусном пучке) для контроля позиционирования пациента.
Результаты: ранние лучевые реакции были выражены в виде лучевого мукозита I‒II степени, лучевого дерматита I‒II степени. Один пациент погиб из-за развития профузного кровотечения через 3 нед. после окончания лучевого лечения. Объективный ответ был достигнут у 6 из 8 пациентов. При медиане наблюдения 11 мес. не возникло развития поздних лучевых осложнений, приводящих к снижению качества жизни.
Заключение: повторная стереотаксическая лучевая терапия в режиме гипофракционирования у пациентов с локорегионарными рецидивами рака головы и шеи является хорошо переносимым видом лечения, обеспечивающим высокие показатели локального контроля с сохранением удовлетворительного качества жизни. Тем не менее риск развития фатальных постлучевых осложнений определяет необходимость тщательного отбора кандидатов для данного вида лечения.
Ключевые слова: повторное облучение, рак головы и шеи, рецидив, гипофракционирование.
Для цитирования: Михайлов А.В., Воробьев Н.А., Сокуренко В.П., Смирнова Е.В., Мартынова Н.И., Гуцало Ю.В. Опыт применения повторного стереотаксического облучения в режиме гипофракционирования при рецидивах рака головы и шеи. РМЖ. Медицинское обозрение. 2017;25(16):1190-1194.
Experience in applying stereotaxic reirradiation in the mode of hypofractionation in cases of head and neck cancer recurrence
Mikhailov A.V.1, Vorobiev N.A.1-3, Sokurenko V.P.4, Smirnova E.V.1, Martynova N.I.1, Gutsalo Yu.V.1
1 Medical and Diagnostic Center of International Institute of Biological Systems named after Berezin Sergei, St. Petersburg
2 North-Western State Medical University named after I.I.Mechnikov, St. Petersburg
3 St. Petersburg State University
4 Russian Research Center of Radiology and Surgical Technologies named after Acad. A.M. Granova, St. Petersburg
Recurrences of head and neck cancer develop in more than half of patients after aggressive primary treatment. Surgical treatment in these cases provides the best results, but it is not always feasible. In this regard, reirradiation remains an actual problem of modern oncology.
Aim to study the tolerability and immediate efficacy according to the criterion of local control of stereotaxic reirradiation in the mode of hypofractionation in patients with local and regional relapses of head and neck cancer.
Patients and methods: 8 patients with local and regional head and neck cancer recurrences were included in the study, who received a course of radiotherapy as part of the initial treatment. Patients underwent a repeated course of radiation therapy in the mode of hypofractionation (35 Gy for 7 fractions). Volumes of irradiation were formed using PET-CT with 18F-FDG, MRI and CT. The dose was administered using the techniques of volumetric modulated arc therapy (VMAT) using IGRT (orthogonal X-ray and CT in a conical beam) to monitor the positioning of the patient.
Results: early radiation reactions were expressed in the form of radial mucositis I-II degree, radiation dermatitis I-II degree. One patient died due to development of profuse bleeding after 3 weeks after the end of radiation treatment. An objective response was achieved in 6 of 8 patients. With a median follow-up of 11 months, there was no development of late radiation complications leading to a decrease in the quality of life.
Conclusion: stereotaxic reirradiation in the mode of hypofractionation in patients with locoregional recurrence of head and neck cancer is a well tolerated type of treatment that provides high local control results while maintaining a satisfactory quality of life. Nevertheless, the risk of developing fatal post-radiation complications determines the need for careful selection of candidates for this type of treatment.
Key words: reirradiation, head and neck cancer, relapse, hypofraction.
For citation: Mikhailov A.V., Vorobiev N.A., Sokurenko V.P. et al. Experience in applying stereotaxic reirradiation in the mode of hypofractionation in cases of head and neck cancer recurrence // RMJ. 2017. № 16. P. 1190–1194.
Mikhailov A.V.1, Vorobiev N.A.1-3, Sokurenko V.P.4, Smirnova E.V.1, Martynova N.I.1, Gutsalo Yu.V.1
1 Medical and Diagnostic Center of International Institute of Biological Systems named after Berezin Sergei, St. Petersburg
2 North-Western State Medical University named after I.I.Mechnikov, St. Petersburg
3 St. Petersburg State University
4 Russian Research Center of Radiology and Surgical Technologies named after Acad. A.M. Granova, St. Petersburg
Recurrences of head and neck cancer develop in more than half of patients after aggressive primary treatment. Surgical treatment in these cases provides the best results, but it is not always feasible. In this regard, reirradiation remains an actual problem of modern oncology.
Aim to study the tolerability and immediate efficacy according to the criterion of local control of stereotaxic reirradiation in the mode of hypofractionation in patients with local and regional relapses of head and neck cancer.
Patients and methods: 8 patients with local and regional head and neck cancer recurrences were included in the study, who received a course of radiotherapy as part of the initial treatment. Patients underwent a repeated course of radiation therapy in the mode of hypofractionation (35 Gy for 7 fractions). Volumes of irradiation were formed using PET-CT with 18F-FDG, MRI and CT. The dose was administered using the techniques of volumetric modulated arc therapy (VMAT) using IGRT (orthogonal X-ray and CT in a conical beam) to monitor the positioning of the patient.
Results: early radiation reactions were expressed in the form of radial mucositis I-II degree, radiation dermatitis I-II degree. One patient died due to development of profuse bleeding after 3 weeks after the end of radiation treatment. An objective response was achieved in 6 of 8 patients. With a median follow-up of 11 months, there was no development of late radiation complications leading to a decrease in the quality of life.
Conclusion: stereotaxic reirradiation in the mode of hypofractionation in patients with locoregional recurrence of head and neck cancer is a well tolerated type of treatment that provides high local control results while maintaining a satisfactory quality of life. Nevertheless, the risk of developing fatal post-radiation complications determines the need for careful selection of candidates for this type of treatment.
Key words: reirradiation, head and neck cancer, relapse, hypofraction.
For citation: Mikhailov A.V., Vorobiev N.A., Sokurenko V.P. et al. Experience in applying stereotaxic reirradiation in the mode of hypofractionation in cases of head and neck cancer recurrence // RMJ. 2017. № 16. P. 1190–1194.
В статье представлен опыт применения повторного стереотаксического облучения в режиме гипофракционирования при рецидивах рака головы и шеи
Введение
Локальные и локорегионарные рецидивы рака головы и шеи после первичного радикального лечения развиваются приблизительно в половине случаев в сроки от 6 мес. до 5 лет [1]. В анамнезе у данных пациентов, как правило, присутствует интенсивное радикальное лечение первичной опухоли, включающее хирургическое вмешательство, лучевую терапию с конкурентной химиотерапией или без нее.Хирургическое вмешательство по поводу рецидива при возможности его выполнения является наиболее эффективным способом лечения и может обеспечить 2-летнюю безрецидивную выживаемость до 36% [2]. По данным метаанализа 32 исследований (1080 пациентов), проведенного в 2011 г., общая 5-летняя выживаемость при хирургическом лечении рецидива составила 39% [1]. Паллиативная химиотерапия и таргетная терапия (цисплатин, 5-фторурацил и цетуксимаб) не отличаются высокой эффективностью и обеспечивают медиану безрецидивной и общей выживаемости 5,6 и 10,1 мес. соответственно [3].
Несмотря на значительный прогресс в хирургии рецидивов опухолей головы и шеи, в абсолютном большинстве случаев эти больные неоперабельны по причине распространенности процесса, наличия тяжелой сопутствующей патологии либо технической невозможности выполнить условно радикальное оперативное вмешательство, и лучевая терапия остается основным методом лечения большинства пациентов с рецидивами рака головы и шеи после первичного оперативного, лучевого, химиотерапевтического лечения или их комбинаций [4].
На сегодняшний день существует опыт успешного применения современных методик конформного облучения IMRT (Intensity Modulated Radiation Therapy) и VMAT (Volumetric Modulated Arc Therapy) в режиме обычного фракционирования при повторном облучении пациентов с рецидивами рака головы и шеи [5]. По данным ряда авторов, данные методики обеспечивают показатели локального контроля до 80% и 2-летней безрецидивной выживаемости до 50% [6].
С появлением технических возможностей конформного облучения с созданием значительных дозных градиентов значительное развитие получила стереотаксическая лучевая терапия в режиме гипофракционирования. Данная методика хорошо зарекомендовала себя при радикальном лечении локализованных форм рака предстательной железы [7], легкого [8], а также при паллиативном облучении метастазов в легкие, печень, головной мозг и кости [9].
Из-за наличия большого количества критических органов и структур в области головы и шеи, необходимости подведения высокой суммарной дозы к потенциально радиорезистентной рецидивной опухоли применение стереотаксической лучевой терапии при рецидивах рака головы и шеи представляет значительный интерес [10]. На сегодняшний день отсутствуют какие-либо четкие рекомендации по формированию радиотерапевтических объемов и предписанию доз при повторном облучении в режиме гипофракционирования, в связи с чем требуется дальнейшее изучение возможностей применения данной лечебной опции у больных с рецидивами рака головы и шеи.
Цель: изучение переносимости инепосредственной эффективности по критерию локального контроля повторной стереотаксической лучевой терапии в режиме гипофракционирования у больных с локальными и регионарными рецидивами рака головы и шеи.
Материал и методы
В исследование включены 8 пациентов (5 мужчин, 3 женщины) с морфологически подтвержденными рецидивами рака головы и шеи, получившие повторное стереотаксическое облучение в ЛДЦ МИБС им. С. Березина с 2013 по 2017 г. Возраст пациентов составил 38 лет – 72 года. Данные по локализации опухоли приведены в таблице 1, гистологическому типу рецидивной опухоли – в таблице 2. Период времени с момента первичного облучения составил от 6 до 38 мес. Суммарная доза при первичном облучении варьировала от 44 до 66 Гр в режиме обычного фракционирования.
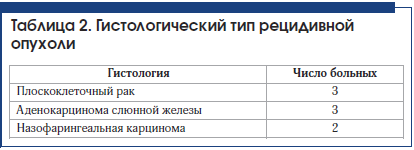
С целью исключения отдаленного метастазирования, а также для более точного определения границ области рецидива на фоне постлучевых и послеоперационных фиброзных изменений всем пациентам выполнялась позитронно-эмиссионная томография, совмещенная с компьютерной томографией (ПЭТ-КТ) всего тела с 18F-фтордезоксиглюкозой (18F-ФДГ).
Для иммобилизации пациентов использовались термопластические маски. При проведении предлучевой подготовки пациентам выполнялись КТ, МРТ с контрастированием и ПЭТ-КТ с 18F-ФДГ с последующим совмещением изображений. Объем GTV (Gross Tumor Volume) формировался на основании данных ПЭТ-КТ (рис. 1), оконтуривание критических органов и структур выполнялось по КТ и МРТ. С целью компенсации ежедневных погрешностей позиционирования создавался отступ для PTV (Planned Treatment Volume) до 5 мм от GTV с уменьшением до 1 мм в области критических структур.
Предписанная суммарная доза составила 35 Гр, доза за фракцию – 7 Гр, число фракций – 5, ритм облучения – ежедневно. Данный режим облучения эквивалентен 70 Гр в режиме обычного фракционирования по поздним лучевым повреждениям.
Расчет эквивалентных доз для поздних лучевых повреждений производился по линейно-квадратичной модели с помощью формулы
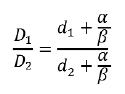
где D1 – суммарная доза в режиме обычного фракционирования, D2 – суммарная доза в режиме модифицированного фракционирования, d1 – доза за фракцию в режиме обычного фракционирования, d2 – доза за фракцию.
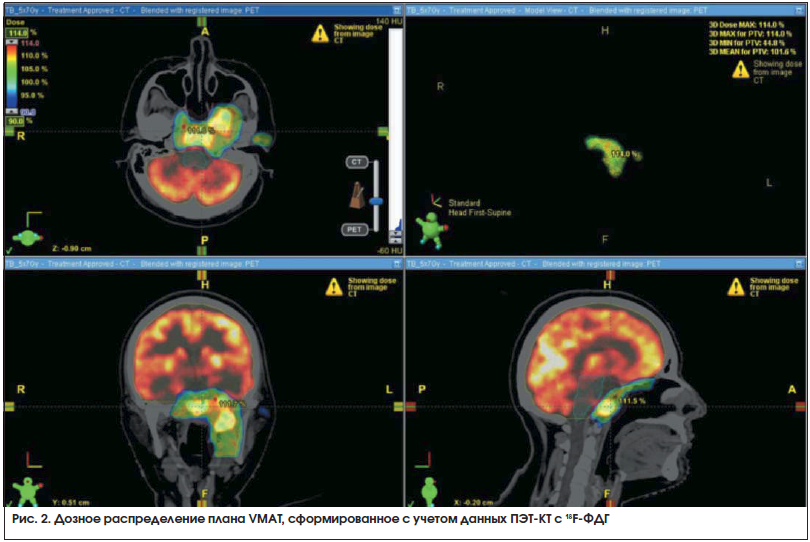
Дозиметрическое планирование проводилось с использованием программного обеспечения Eclipse 10 (Varian) и Multiplan 8.0 (Accuray). Пример дозного распределения при облучении рецидива назофарингеальной карциномы носоглотки представлен на рис. 2. Определяя максимально допустимые дозы на критические органы при планировании повторного облучения, мы руководствовались литературными данными [11], согласно которым считается, что практически полное восстановление толерантных доз для структур ЦНС (ствол мозга, зрительные нервы и их перекрест, спинной мозг) происходит в течение 1,5–2 лет с момента первичного облучения. Другие авторы описывают безопасное подведение к мягким тканям шеи до 60 Гр при повторном облучении через год после первичной лучевой терапии [12]. При планировании лучевой терапии толерантные дозы критических органов и тканей были соблюдены.
Облучение пациентов проведено на установках TrueBeam STx (Varian) и CyberKnife (Accuray). Для контроля точности позиционирования использовались ортогональные рентгеновские снимки и КТ в конусном пучке ежедневно, отклонения не превысили 1 мм.
Лучевые реакции и поздние осложнения лечения оценивались по критериям EORTC/RTOG. Непосредственный эффект лечения оценивался через месяц после окончания лучевой терапии в соответствии с критериями RECIST по данным КТ и МРТ-исследования и у части пациентов по данным ПЭТ-КТ с 18F-ФДГ.
Результаты
Всем 8 пациентам удалось выполнить запланированное лечение. Во время лечения у 2-х пациентов отмечено усиление болевого синдрома, купированное назначением нестероидных противовоспалительных средств, у 1 пациента отмечено развитие лучевого дерматита I степени (гиперемия кожи в области облучения). В процессе наблюдения за пациентами в течение 2-х недель с момента облучения у 6 пациентов отмечено развитие лучевого эпителиита слизистой глотки II степени, разрешившегося к 4-й неделе с момента окончания лечения.При контрольном обследовании через месяц объективный ответ был отмечен у всех 8 пациентов в виде частичного регресса облученной опухоли (5 больных) и стабилизации размеров опухоли с появлением неоднородности структуры, соответствующей постлучевым некротическим изменениям (3 больных). При контрольном обследовании через 3 мес. с момента проведения лечения сохранялась тенденция к уменьшению размеров облученных очагов. У 4-х пациентов на данном сроке наблюдения по результатам ПЭТ-КТ с 18F-ФДГ отмечено снижение показателей SUVmax (Standardized Uptake Value) до значений, соответствующих постлучевым изменениям (SUVmax 4,0–5,0).
К настоящему моменту живы 6 больных. Медиана наблюдения составила 11 мес., у выживших пациентов нет признаков продолженного роста или рецидива в области повторного облучения. У 1 пациента отмечено прогрессирование заболевания с появлением отдаленных метастазов в легких. Один пациент погиб от профузного кровотечения из крупных сосудов через 3 нед. после повторного облучения, еще один пациент погиб вследствие сопутствующей патологии (острая недостаточность мозгового кровообращения) через 4 мес. после лечения.
За период наблюдения у выживших больных не отмечено развития поздних лучевых повреждений и снижения качества жизни.
Обсуждение
По литературным данным, проведение повторной лучевой терапии с использованием конвенциональных методик не обеспечивает удовлетворительных результатов по локальному контролю и выживаемости [13]. Так, по результатам исследования RTOG 9911 2-летняя безрецидивная выживаемость составила 16%, 2-летняя общая выживаемость – 26% [14]. Облучение с использованием конвенциональных методик характеризуется высокой частотой развития поздних лучевых повреждений III и IV степени, проявляющихся остеорадионекрозами, некрозами хрящей гортани, тризмом жевательной мускулатуры и лучевыми повреждениями констрикторов глотки [15].Исходя из предположения о том, что рецидив происходит из клона наиболее радиорезистентных клеток, переживших лучевую терапию при первичном лечении, повторное облучение должно проводиться с подведением высоких суммарных доз с целью преодоления радиорезистентности [16]. На практике это трудновыполнимая задача из-за более низких толерантных доз окружающих тканей и критических структур после первичного облучения.
Таким образом, решение этой задачи, с одной стороны, требует уменьшения объема облучения за счет более точного определения границ рецидивной опухоли, а с другой – применения высокоточных конформных методик фотонного облучения или локального подведения высоких доз с применением брахитерапии [17]. Другим способом преодоления радиорезистентности рецидивной опухоли является использование нестандартных режимов фракционирования дозы, например увеличения дозы за фракцию [18].
Одна из основных задач при планировании повторного облучения заключается в точном определении границ рецидивной опухоли, что в большинстве случаев бывает затруднено в связи с наличием в зоне рецидива фиброзных изменений после ранее перенесенного хирургического вмешательства или радикального курса лучевой терапии [19]. На фоне таких изменений использование традиционных методов визуализации в виде КТ и МРТ с контрастированием не всегда позволяет визуализировать рецидивную опухоль. Способом решения этой проблемы стало использование совмещенных радиоизотопных методов лучевой диагностики, визуализирующих метаболизм опухолевой ткани, наиболее доступный из которых – ПЭТ-КТ с 18F–ФДГ [20]. Данный метод позволяет визуализировать объем метаболически активной опухоли и по КТ-составляющей точно локализовать его, что является критичным при оконтуривании объема облучения.
В нашем исследовании мы оценили переносимость, непосредственные результаты проведения повторной конформной лучевой терапии в режиме гипофракционирования при локорегионарных рецидивах рака головы и шеи, а также частоту развития поздних лучевых реакций и повреждений.
По данным нашего исследования, при повторном конформном облучении с использованием гипофракционирования не происходило повышения частоты развития ранних лучевых реакций (мукозиты, лучевой дерматит) в сравнении с первичным облучением с применением тех же методик и режима фракционирования. Отсутствие усиления ранней лучевой токсичности согласуется с имеющимися литературными данными [21].
Наиболее вероятно, отсутствие усиления ранней лучевой токсичности в нашем исследовании связано с меньшими значениями объемов высокодозного облучения. Уменьшение объемов было достигнуто за счет применения ПЭТ-КТ с 18F-ФДГ при оконтуривании GTV, в связи с чем не было необходимости в увеличении отступа для CTV, связанного с неопределенностью визуализации границ рецидивной опухоли. Также благодаря применению средств IGRT (киловольтные снимки и КТ в конусном пучке) удалось сократить отступ PTV до 5 мм, а в области критических структур центральной нервной системы до 1 мм.
При медиане наблюдения в 11 мес. у пациентов не наблюдалось поздней лучевой токсичности в виде остеонекрозов, некрозов мягких тканей и радиационных повреждений структур центральной нервной системы. Наши данные согласуются с результатами работ других авторов, проводивших повторное облучение при рецидивах или первично-множественных метахронных опухолях области головы и шеи, в которых показано практически полное восстановление толерантных доз спинного мозга, кожи и мягких тканей через год после первичного облучения [22].
Заключение
Таким образом, повторная стереотаксическая лучевая терапия в режиме гипофракционирования у пациентов с локорегионарными рецидивами рака головы и шеи является хорошо переносимым видом лечения, обеспечивающим высокие показатели локального контроля с сохранением удовлетворительного качества жизни. Тем не менее риск развития фатальных постлучевых осложнений определяет необходимость тщательного отбора кандидатов для данного вида лечения.
Литература
1. Blanchard P., Baujat B., Holostenco V. et al. Meta-analysis of chemotherapy in head and neck cancer (MACH-NC): a comprehensive analysis by tumour site // Radiother. Oncol. 2011. Vol. 100. P.33–40.
2. Goodwin W.J. Jr. Salvage surgery for patients with recurrent squamous cell carcinoma of the upper aerodigestive tract: when do the ends justify the means? // Laryngoscope. 2000. Vol. 110. Suppl 93. P.1–18.
3. Vermorken J.B., Mesia R., Rivera F. et al. Platinum-based chemotherapy plus cetuximab in head and neck cancer. // N. Engl. J. Med. 2008. Vol. 359. P.1116–1127.
4. Strojan P., Corry J., Eisbruch A. et al. Recurrent and second primary squamous cell carcinoma of the head and neck: When and how to reirradiate // Head Neck. 2015. Vol. 37 (1). P.134–150.
5. Duprez F., Madani I., Bonte K. et al. Intensity-modulated radiotherapy for recurrent and second primary head and neck cancer in previously irradiated territory // Radiother. Oncol. 2009. Vol. 93. P.563–569.
6. Ozyigit G., Cengiz M., Yazici G. et al. A retrospective comparison of robotic stereotactic body radiotherapy and three-dimensional conformal radiotherapy for the reirradiation of local recurrent nasopharyngeal carcinoma // Int. J. Radiat. Oncol. Biol. Phys. 2011. Vol. 81. P.263–268.
7. Benjamin L.C., Tree A.C., Dearnaley D.P. The Role of Hypofractionated Radiotherapy in Prostate Cancer // Curr Oncol Rep. 2017. Vol. 19. P.30.
8. Zhang J., Fan M., Liu D. et al. Hypo- or conventionally fractionated radiotherapy combined with chemotherapy in patients with limited stage small cell lung cancer // Radiat Oncol. 2017. Vol. 12. P.51.
9. Lutz S.T., Jones J., Chow E. Role of radiation therapy in palliative care of the patient with cancer // J Clin Oncol. 2014. Vol. 32. P.9.
10. Yamazaki H., Kodani N., Ogita M. et al. Reirradiation of head and neck cancer focusing on hypofractionated stereotactic body radiation therapy // Radiat Oncol. 2011. Vol. 6. P.98.
11. Kirkpatrick J.P., Van der Kogel A.J., Schultheiss T.E. Radiation dose-volume effects in the spinal cord // Int. J. Radiat. Oncol. Biol. Phys. 2010. Vol. 76(3 Suppl). P.42–49.
12. Jeong S., Yoo E.J., Kim J.Y. et al. Re-irradiation of unresectable recurrent head and neck cancer: using Helical Tomotherapy as image-guided intensity-modulated radiotherapy // Radiat. Oncol. J. 2013. Vol. 31(4). P.206–215.
13. Jayaram S.C., Muzaffar S.J., Ahmed I. et al. The efficacy, outcomes and complication rates of different surgical and nonsurgical treatment modalities for recurrent/residual oropharyngeal carcinoma: a systematic review and meta-analysis // Head Neck. 2016. Vol. 38. P.1855–1861.
14. Langer C.J., Harris J., Horwitz E.M. et al Phase II study of low-dose paclitaxel and cisplatin in combination with split-course concomitant twicedaily reirradiation in recurrent squamous cell carcinoma of the head and neck: results of Radiation Therapy Oncology Group Protocol 9911 // J. Clin. Oncol. 2007. Vol. 25. P.4800–4805.
15. Paleri V., Roe J.W.G., Strojan P. et al. Strategies to reduce long-term postchemoradiation dysphagia in patients with head and neck cancer: an evidence-based review // Head Neck. 2013. Vol. 36 (3). P.431–443.
16. Ohizumi Y., Tamai Y., Imamiya S., Akiba T. Prognostic factors of reirradiation for recurrent head and neck cancer //Am. J. Clin. Oncol. 2002. Vol. 25. P.408–413.
17. Pham A., Arora S., Wernicke A.G. et al Cesium-131 brachytherapy in high risk and recurrent head and neck cancers: first report of long-term outcomes // J. Contemp. Brachytherapy. 2015 Dec. Vol. 7(6). P.445–452.
18. Yamazaki H., Kodani N., Ogita M. et al. Reirradiation of head and neck cancer focusing on hypofractionated stereotactic body radiation therapy // Radiat. Oncol. 2011. Vol. 6. P.98.
19. Gupta T., Master Z., Kannan S. et al. Diagnostic performance of post-treatment FDG PET or FDG PET/CT imaging in head and neck cancer: a systematic review and meta-analysis // Eur. J. Nucl. Med. Mol. Imaging. 2011. Vol. 38. P.2083–2095.
20. Dunsky K.A., Wehrmann D.J., Osman M.M. et al. PET-CT and the detection of the asymptomatic recurrence or second primary lesions in the treated head and neck cancer patient // Laryngoscope. 2013. Vol. 123. P.2161–2164.
21. Kong L. et al. Salvage Intensity-Modulated Radiation Therapy (IMRT) for Locally Recurrent Nasopharyngeal Cancer after Definitive IMRT: A Novel Scenario of the Modern Era. Sci. Rep. 6, 32883. doi: 10.1038/srep32883
22. Nieder C., Milas L., Ang K.K. Tissue tolerance to reirradiation // Semin. Radiat. Oncol. 2000. Vol. 10(3). P.200–209.
2. Goodwin W.J. Jr. Salvage surgery for patients with recurrent squamous cell carcinoma of the upper aerodigestive tract: when do the ends justify the means? // Laryngoscope. 2000. Vol. 110. Suppl 93. P.1–18.
3. Vermorken J.B., Mesia R., Rivera F. et al. Platinum-based chemotherapy plus cetuximab in head and neck cancer. // N. Engl. J. Med. 2008. Vol. 359. P.1116–1127.
4. Strojan P., Corry J., Eisbruch A. et al. Recurrent and second primary squamous cell carcinoma of the head and neck: When and how to reirradiate // Head Neck. 2015. Vol. 37 (1). P.134–150.
5. Duprez F., Madani I., Bonte K. et al. Intensity-modulated radiotherapy for recurrent and second primary head and neck cancer in previously irradiated territory // Radiother. Oncol. 2009. Vol. 93. P.563–569.
6. Ozyigit G., Cengiz M., Yazici G. et al. A retrospective comparison of robotic stereotactic body radiotherapy and three-dimensional conformal radiotherapy for the reirradiation of local recurrent nasopharyngeal carcinoma // Int. J. Radiat. Oncol. Biol. Phys. 2011. Vol. 81. P.263–268.
7. Benjamin L.C., Tree A.C., Dearnaley D.P. The Role of Hypofractionated Radiotherapy in Prostate Cancer // Curr Oncol Rep. 2017. Vol. 19. P.30.
8. Zhang J., Fan M., Liu D. et al. Hypo- or conventionally fractionated radiotherapy combined with chemotherapy in patients with limited stage small cell lung cancer // Radiat Oncol. 2017. Vol. 12. P.51.
9. Lutz S.T., Jones J., Chow E. Role of radiation therapy in palliative care of the patient with cancer // J Clin Oncol. 2014. Vol. 32. P.9.
10. Yamazaki H., Kodani N., Ogita M. et al. Reirradiation of head and neck cancer focusing on hypofractionated stereotactic body radiation therapy // Radiat Oncol. 2011. Vol. 6. P.98.
11. Kirkpatrick J.P., Van der Kogel A.J., Schultheiss T.E. Radiation dose-volume effects in the spinal cord // Int. J. Radiat. Oncol. Biol. Phys. 2010. Vol. 76(3 Suppl). P.42–49.
12. Jeong S., Yoo E.J., Kim J.Y. et al. Re-irradiation of unresectable recurrent head and neck cancer: using Helical Tomotherapy as image-guided intensity-modulated radiotherapy // Radiat. Oncol. J. 2013. Vol. 31(4). P.206–215.
13. Jayaram S.C., Muzaffar S.J., Ahmed I. et al. The efficacy, outcomes and complication rates of different surgical and nonsurgical treatment modalities for recurrent/residual oropharyngeal carcinoma: a systematic review and meta-analysis // Head Neck. 2016. Vol. 38. P.1855–1861.
14. Langer C.J., Harris J., Horwitz E.M. et al Phase II study of low-dose paclitaxel and cisplatin in combination with split-course concomitant twicedaily reirradiation in recurrent squamous cell carcinoma of the head and neck: results of Radiation Therapy Oncology Group Protocol 9911 // J. Clin. Oncol. 2007. Vol. 25. P.4800–4805.
15. Paleri V., Roe J.W.G., Strojan P. et al. Strategies to reduce long-term postchemoradiation dysphagia in patients with head and neck cancer: an evidence-based review // Head Neck. 2013. Vol. 36 (3). P.431–443.
16. Ohizumi Y., Tamai Y., Imamiya S., Akiba T. Prognostic factors of reirradiation for recurrent head and neck cancer //Am. J. Clin. Oncol. 2002. Vol. 25. P.408–413.
17. Pham A., Arora S., Wernicke A.G. et al Cesium-131 brachytherapy in high risk and recurrent head and neck cancers: first report of long-term outcomes // J. Contemp. Brachytherapy. 2015 Dec. Vol. 7(6). P.445–452.
18. Yamazaki H., Kodani N., Ogita M. et al. Reirradiation of head and neck cancer focusing on hypofractionated stereotactic body radiation therapy // Radiat. Oncol. 2011. Vol. 6. P.98.
19. Gupta T., Master Z., Kannan S. et al. Diagnostic performance of post-treatment FDG PET or FDG PET/CT imaging in head and neck cancer: a systematic review and meta-analysis // Eur. J. Nucl. Med. Mol. Imaging. 2011. Vol. 38. P.2083–2095.
20. Dunsky K.A., Wehrmann D.J., Osman M.M. et al. PET-CT and the detection of the asymptomatic recurrence or second primary lesions in the treated head and neck cancer patient // Laryngoscope. 2013. Vol. 123. P.2161–2164.
21. Kong L. et al. Salvage Intensity-Modulated Radiation Therapy (IMRT) for Locally Recurrent Nasopharyngeal Cancer after Definitive IMRT: A Novel Scenario of the Modern Era. Sci. Rep. 6, 32883. doi: 10.1038/srep32883
22. Nieder C., Milas L., Ang K.K. Tissue tolerance to reirradiation // Semin. Radiat. Oncol. 2000. Vol. 10(3). P.200–209.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
