Особенности генитоуринарного статуса пациенток репродуктивного возраста после гистерэктомии
РМЖ. Мать и дитя. №26 от 01.12.2017 стр. 1913-1920
Рубрика:
Гинекология
Акушерство
Радикальные операции на матке могут способствовать нарушению сложных нейроэндокринных взаимоотношений и приводить к вероятным изменениям функции тазовых органов и тазового дна. Часто встречаются проявления генитоуринарных расстройств у женщин репродуктивного возраста, перенесших гистерэктомию (ГЭ).
Цель исследования: изучить урологический статус 233 пациенток репродуктивного возраста, подвергшихся ГЭ.
Материал и методы: 1-ю группу составили 113 пациенток, которым была проведена надвлагалищная ампутация матки (субтотальная ГЭ) без придатков по поводу миомы матки, 2-ю группу – 120 пациенток после экстирпации матки без придатков (тотальная ГЭ) по поводу миомы матки, 3-ю группу – 25 пациенток с миомой матки небольших размеров, находящихся на диспансерном наблюдении (группа сравнения).
Результаты: у 183 пациенток после ГЭ выявлены различные жалобы со стороны урогенитального тракта (78,5%): 55 пациенток из числа прооперированных отметили урологические симптомы (23,6%), 78 – гинекологические (33,5%). Сочетание урологических и гинекологических проблем обнаружено у 50 больных (21,5%). У пациенток с цистоуретритом средний уровень эстрадиола (Е2) составил 85,5±5,8 пг/мл, с недержанием мочи – 58,7±3,8 пг/мл, с императивным недержанием – 52,3±3,5 пг/мл, что достоверно ниже содержания гормона у пациенток без подобной симптоматики (в группе сравнения – 150,8±18,5 пг/мл). Из 83 пациенток с генитоуринарными расстройствами последние сочетались с нейровегетативными проявлениями у 66 пациенток (79,5%); у оставшихся 17 пациенток (20,5%) генитоуринарные симптомы наблюдались самостоятельно. Проводилась локальная, системная и сочетанная менопаузальная гормональная терапия (МГТ) в зависимости от степени тяжести генитоуринарных расстройств. В целом было выявлено положительное действие гормонотерапии на клиническую и инструментальную картину генитоуринарных расстройств.
Заключение: позитивное влияние гормонотерапии доказывает, что одну из основных ролей в развитии симптоматики со стороны генитального тракта играет снижение уровня эстрадиола, восполнение которого при приеме МГТ и обеспечивает эффект препаратов.
Ключевые слова: миома матки, гистерэктомия, генитоуринарные расстройства, синдром постгистерэктомии, нейровегетативные расстройства, недержание мочи, императивное недержание мочи, стрессовое недержание мочи, гинекологические расстройства, урологические расстройства.
Цель исследования: изучить урологический статус 233 пациенток репродуктивного возраста, подвергшихся ГЭ.
Материал и методы: 1-ю группу составили 113 пациенток, которым была проведена надвлагалищная ампутация матки (субтотальная ГЭ) без придатков по поводу миомы матки, 2-ю группу – 120 пациенток после экстирпации матки без придатков (тотальная ГЭ) по поводу миомы матки, 3-ю группу – 25 пациенток с миомой матки небольших размеров, находящихся на диспансерном наблюдении (группа сравнения).
Результаты: у 183 пациенток после ГЭ выявлены различные жалобы со стороны урогенитального тракта (78,5%): 55 пациенток из числа прооперированных отметили урологические симптомы (23,6%), 78 – гинекологические (33,5%). Сочетание урологических и гинекологических проблем обнаружено у 50 больных (21,5%). У пациенток с цистоуретритом средний уровень эстрадиола (Е2) составил 85,5±5,8 пг/мл, с недержанием мочи – 58,7±3,8 пг/мл, с императивным недержанием – 52,3±3,5 пг/мл, что достоверно ниже содержания гормона у пациенток без подобной симптоматики (в группе сравнения – 150,8±18,5 пг/мл). Из 83 пациенток с генитоуринарными расстройствами последние сочетались с нейровегетативными проявлениями у 66 пациенток (79,5%); у оставшихся 17 пациенток (20,5%) генитоуринарные симптомы наблюдались самостоятельно. Проводилась локальная, системная и сочетанная менопаузальная гормональная терапия (МГТ) в зависимости от степени тяжести генитоуринарных расстройств. В целом было выявлено положительное действие гормонотерапии на клиническую и инструментальную картину генитоуринарных расстройств.
Заключение: позитивное влияние гормонотерапии доказывает, что одну из основных ролей в развитии симптоматики со стороны генитального тракта играет снижение уровня эстрадиола, восполнение которого при приеме МГТ и обеспечивает эффект препаратов.
Ключевые слова: миома матки, гистерэктомия, генитоуринарные расстройства, синдром постгистерэктомии, нейровегетативные расстройства, недержание мочи, императивное недержание мочи, стрессовое недержание мочи, гинекологические расстройства, урологические расстройства.
Features of genitourinary status of patients of reproductive age after hysterectomy
Dobrokhotova Yu.E., Ilina I.Yu.
Russian National Research Medical University named after N.I. Pirogov, Moscow
Radical operations on the uterus can contribute to the disruption of complex neuroendocrine interrelations and lead to possible changes in the function of the pelvic organs and pelvic floor. Women of reproductive age who underwent a hysterectomy often have the manifestations of genitourinary disorders.
The aim is to study the urological status of 233 patients of reproductive age who underwent hysterectomy.
Patients and methods: the first group consisted of 113 patients who underwent subtotal hysterectomy (SH) for uterine myoma, the second group - 120 patients after total hysterectomy (TH) for uterine myoma, and the third group - 25 patients on dispensary observation with a small uterine myoma (comparison group).
Results: 183 patients after hysterectomy had various urogenital complaints (78.5%). 55 operated patients noted urologic symptoms (23.6%); 78 patients – gynecological symptoms (33.5%). The combination of urological and gynecological problems was found in 50 patients (21.5%). In patients with cystourethritis, the mean level of estradiol (E2) was 85.5 ± 5.8 pg / ml, in women with urinary incontinence - 58.7 ± 3.8 pg / ml, and in persons with urgency urinary incontinence - 52.3 ± 3.5 pg / ml, which is significantly lower than the hormone level in patients without similar symptoms (in the comparison group E2 - 150.8 ± 18.5 pg / ml). Among 83 patients with genitourinary disorders, the latter were combined with neurovegetative manifestations in 79.5% (66 patients); the remaining 20.5% (17 patients) had only genitourinary symptoms. Local, systemic and combined menopausal hormonal therapy (MHT) was appointed depending on the degree of severity of genitourinary disorders. In general, the positive effect of hormone therapy on the clinical and instrumental picture of genitourinary disorders was revealed.
Conclusion: the positive effect of hormonal therapy proves that one of the main roles in the development of the symptomatology of the genital tract is the decrease in the level of estradiol, which is replenished by MHT and provides the effect of the drugs.
Key words: uterine myoma, hysterectomy, genitourinary disorders, post-hysterectomy syndrome, neurovegetative disorders, urinary incontinence, urgency urinary incontinence, stress urinary incontinence, gynecological disorders, urological disorders.
For citation: Dobrokhotova Yu.E., Ilina I.Yu. Features of genitourinary status of patients of reproductive age after hysterectomy // RMJ. 2017. № 26.
P. 1913–1920.
Dobrokhotova Yu.E., Ilina I.Yu.
Russian National Research Medical University named after N.I. Pirogov, Moscow
Radical operations on the uterus can contribute to the disruption of complex neuroendocrine interrelations and lead to possible changes in the function of the pelvic organs and pelvic floor. Women of reproductive age who underwent a hysterectomy often have the manifestations of genitourinary disorders.
The aim is to study the urological status of 233 patients of reproductive age who underwent hysterectomy.
Patients and methods: the first group consisted of 113 patients who underwent subtotal hysterectomy (SH) for uterine myoma, the second group - 120 patients after total hysterectomy (TH) for uterine myoma, and the third group - 25 patients on dispensary observation with a small uterine myoma (comparison group).
Results: 183 patients after hysterectomy had various urogenital complaints (78.5%). 55 operated patients noted urologic symptoms (23.6%); 78 patients – gynecological symptoms (33.5%). The combination of urological and gynecological problems was found in 50 patients (21.5%). In patients with cystourethritis, the mean level of estradiol (E2) was 85.5 ± 5.8 pg / ml, in women with urinary incontinence - 58.7 ± 3.8 pg / ml, and in persons with urgency urinary incontinence - 52.3 ± 3.5 pg / ml, which is significantly lower than the hormone level in patients without similar symptoms (in the comparison group E2 - 150.8 ± 18.5 pg / ml). Among 83 patients with genitourinary disorders, the latter were combined with neurovegetative manifestations in 79.5% (66 patients); the remaining 20.5% (17 patients) had only genitourinary symptoms. Local, systemic and combined menopausal hormonal therapy (MHT) was appointed depending on the degree of severity of genitourinary disorders. In general, the positive effect of hormone therapy on the clinical and instrumental picture of genitourinary disorders was revealed.
Conclusion: the positive effect of hormonal therapy proves that one of the main roles in the development of the symptomatology of the genital tract is the decrease in the level of estradiol, which is replenished by MHT and provides the effect of the drugs.
Key words: uterine myoma, hysterectomy, genitourinary disorders, post-hysterectomy syndrome, neurovegetative disorders, urinary incontinence, urgency urinary incontinence, stress urinary incontinence, gynecological disorders, urological disorders.
For citation: Dobrokhotova Yu.E., Ilina I.Yu. Features of genitourinary status of patients of reproductive age after hysterectomy // RMJ. 2017. № 26.
P. 1913–1920.
В статье рассмотрены особенности генитоуринарного статуса пациенток репродуктивного возраста после гистерэктомии. Показано позитивное влияние гормонотерапии, что доказывает важную роль снижения уровня эстрадиола, восполнение которого при приеме менопаузальной гормональной терапии и обеспечивает эффект препаратов.
Введение
Известно, что радикальные операции на матке могут способствовать нарушению сложных нейроэндокринных взаимоотношений в системе гипоталамус – гипофиз – яичники – кора надпочечников – щитовидная железа, вызывать нарушения системы шейка матки – тело матки – яичники в связи с неизбежным повреждением кровеносной, лимфатической и нервной систем этих и окружающих органов и в результате приводить к вероятным изменениям функции тазовых органов и тазового дна [1]. В связи с этим одним из направлений оперативной гинекологии в последние годы при доброкачественной патологии гениталий является органосохраняющая тактика, в частности, имеющая целью сохранить оба яичника или хотя бы их часть [2–4]. Кроме того, в основе этого тактического подхода заложена и идея целесообразности оставления шейки матки как гормонзависимого органа в рамках выбора между тотальной и субтотальной гистерэктомией (ГЭ) [5, 6]. Понятно, что для достижения этой цели необходим тщательный анализ данных ближайших и отдаленных результатов в соответствии с поставленными задачами, что в конечном счете должно способствовать адекватному выбору объема оперативного вмешательства на органах половой системы женщин репродуктивного возраста. В настоящее время каждый практикующий гинеколог, а порой и уролог достаточно часто сталкиваются с проявлением генитоуринарных расстройств у женщин репродуктивного возраста, перенесших ГЭ. Среди всех симптомов генитоуринарных расстройств, развивающихся после ГЭ, произведенной в репродуктивном возрасте, недержание мочи является самой серьезной и распространенной проблемой, которая может быть изнуряющей физически, психологически и стать значительным экономическим бременем [1, 7, 8]. Физически недержание мочи ассоциировано с ограничением подвижности или активности пациенток, с рецидивирующими инфекциями мочевого тракта, кожными высыпаниями и пролежнями [1, 8–10]. Психологически эта проблема нередко сопровождается депрессивными расстройствами [8].Недержание мочи – это патологическое состояние, которое поражает от 10% до 70% женщин независимо от этнической принадлежности [5]. Анализ литературы свидетельствует о достаточно широком распространении этого патологического состояния среди женщин. К тому же важность данной проблемы связана еще и с тем, что обращаемость женщин к специалистам по поводу урогенитальных расстройств, по результатам эпидемиологических исследований, крайне низка [5, 7, 11]. Изучая психоэмоциональный статус женщин, страдающих недержанием мочи,
E.W. Thornton (1997) отметил, что около 40% пациенток имеют отклонения психики функционального характера, хотя они не находились на учете у психиатра и никогда не обращались за помощью к психотерапевту. Психоэмоциональные нарушения проявлялись повышенной раздражительностью, депрессией и сексуальными проблемами, такими как аноргазмия и болезненный коитус [5, 11].
Второй, не менее важной проблемой урологических нарушений является атрофический цистоуретрит (АЦУ), проявляющийся в виде ночной и дневной поллакиурии (учащенное мочеиспускание), цисталгии (жжение, рези, боль при мочеиспускании). Симптомы АЦУ достаточно часто сочетаются с клиникой атрофического вагинита (АВ). Это связано с очень сходными морфологическими характеристиками эпителия влагалища и уротелия [1, 11]. Наиболее частыми симптомами АВ являются сухость, зуд и жжение во влагалище, а также диспареуния. Частота встречаемости АЦУ и АВ составляет, по данным разных авторов, от 40 до 65% [12]. К сожалению, довольно часто течение АЦУ и АВ осложняется присоединением инфекции, и больные, помимо всего прочего, начинают страдать рецидивирующими воспалительными заболеваниям урогенитального тракта. Самые большие опасения вызывает возможность развития восходящей инфекции мочевых путей с появлением уросепсиса и тяжелых пневмоний с возможным летальным исходом.
Вследствие единой общности эмбриологического развития половой и мочевой систем у женщин, их тесными анатомическими взаимоотношениями, системой иннервации и кровоснабжения, а также особенностями связочного аппарата мочевого пузыря существует небезосновательное мнение, что ГЭ связана с прямой или опосредованной травмой мочевых органов, что может сказаться на их функции [13]. С точки зрения лечения основного заболевания, положительный эффект операции не подлежит сомнению, в то время как влияние на функцию мочевого пузыря вызывает много дискуссий [14, 15]. В литературе имеются диаметрально противоположные мнения о влиянии ГЭ на функцию мочевого пузыря (Талина И.С., Дондукова Т.М., 1980). Если ГЭ способствует развитию урогенитальных проблем, то данная клиническая ситуация значительно расширит круг пациенток, нуждающихся в квалифицированной, патогенетически обоснованной медицинской помощи.
Кровоснабжение мочевого пузыря и проксимального отдела уретры, имея обширную сеть сосудистых сплетений, в основном осуществляется за счет верхней и нижней пузырной артерии, а также их ветвей. Необходимо отметить, что верхняя пузырная артерия благодаря своим топографическим особенностям редко повреждается во время операции. Нижняя пузырная артерия имеет несколько вариантов отхождения и чаще вовлекается в зону поражения, особенно в случае ответвления от внутренней подвздошной артерии в проксимальном направлении к маточной, что отмечено в 40% случаев наблюдений [11, 16]. Изучая в эксперименте изменения функции мочевого пузыря после пересечения артериальных стволов, Chen et al. (1996) отметили различные нарушения мочеиспускания, исчезающие в среднем через 40 дней. Данное исследование параллельно с другими многочисленными экспериментальными и клиническими работами показывает, что ведущим в генезе дисфункции нижних мочевых путей после радикальных операций на матке является нарушение иннервации мочевого пузыря и уретры [5, 13, 16]. Но имеется и противоположная точка зрения, указывающая на то, что ГЭ не может привести к нарушению функции мочевого пузыря и уретры. По мнению некоторых авторов, основным звеном патогенеза нарушений уретровезикулярной функции у пациенток после радикальных операций на матке является парасимпатическая и симпатическая денервация мочевого пузыря, мочеиспускательного канала и мышц тазового дна [5, 11]. В настоящее время является принятым мнение, что в основе истинного недержания мочи при напряжении лежит неполная передача внутрибрюшного давления на проксимальную уретру вследствие ее смещения из интраабдоминальной позиции [5, 17, 18]. Дислокация уретровезикального сегмента происходит в основном вследствие ослабления связок, обеспечивающих его правильное анатомическое положение. К ним относятся уретротазовая и пубоуретральная связки [16]. В то же время M.P. Vessey et al. (1992) утверждают, что ни влагалищная, ни абдоминальная ГЭ не могут являться причиной нарушения уродинамики. Несмотря на противоречивость мнений ученых, изучавших данный вопрос, речь в большинстве работ идет об изменениях уродинамики в ранние после операции сроки.
Для создания адекватного повышения внутриуретрального давления необходимы: полноценное состояние уротелия и наличие слизи в просвете уретры; эластичность коллагена, входящего в состав соединительной ткани уретры; сохраненный тонус гладкой мускулатуры уретральной стенки; полноценная васкуляризация уретры (особенно наполнение подслизистых венозных сплетений) [19, 20, 21]. Все описанные структуры являются эстрогензависимыми, в них происходит развитие атрофических процессов при возникновении дефицита эстрогенов [20, 22, 23].
Принимая во внимание имеющиеся сведения о снижении функциональной активности яичников после удаления матки, логично предположить возможность влияния развивающейся гипоэстрогении на риск появления генитоуринарных расстройств, что увеличит количество женщин, страдающих генитоуринарными нарушениями. Проведение операций в репродуктивном возрасте ускорит проявление страдания. Многие урогинекологи, не учитывая особенностей влияния эстрогенного дефицита у женщин репродуктивного возраста после ГЭ на структуры нижней трети урогенитального тракта, считают недержание мочи при напряжении у всех женщин заболеванием, вызванным повреждением и дискоординацией различных анатомических структур урогенитального тракта, чаще всего вследствие перенесенной операции [15, 16]. Интерпретация уродинамических параметров у женщин репродуктивного возраста после ГЭ часто затруднена и субъективна, следовательно, вызывает определенные трудности при выборе терапии.
Таким образом, проблема генитоуринарных расстройств, развивающихся после ГЭ, является актуальной, требующей дальнейшего изучения как возможных этиологических факторов возникновения, так и способов терапии и коррекции появившихся изменений, а также путей профилактики развития генитоуринарных расстройств у женщин репродуктивного возраста после удаления матки.
На кафедре акушерства и гинекологии лечебного факультета ФГБОУ ВО «РНИМУ им. Н.И. Пирогова» было проведено исследование, целью которого явилось изучение урологического статуса 233 пациенток репродуктивного возраста, подвергшихся ГЭ.
Материал и методы
В 1-ю группу вошли 113 пациенток, которым была проведена надвлагалищная ампутация матки (субтотальная ГЭ) без придатков по поводу миомы матки, во 2-ю группу – 120 пациенток после экстирпации матки без придатков (тотальная ГЭ) по поводу миомы матки, в 3-ю – 25 пациенток с миомой матки небольших размеров, находящихся на диспансерном наблюдении (так называемая группа сравнения).Результаты и обсуждение Генитоуринарные расстройства
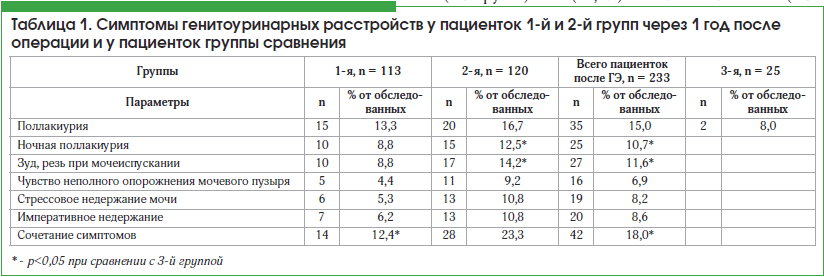
При изучении урогенитального статуса у 183 пациенток после ГЭ были выявлены те или иные жалобы со стороны урогенитального тракта, что составило 78,5%. Причем 55 пациенток из числа прооперированных (233 пациентки подверглись ГЭ) отметили урологические симптомы (23,6%); 78 пациенток – гинекологические (33,5%). Сочетание урологических и гинекологических проблем обнаружено у 50 больных (21,5%) (рис. 1). Распределение урологических жалоб у оперированных пациенток представлено в таблице 1.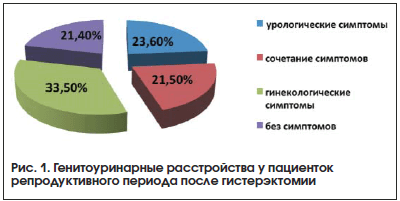
Подчеркнем, что сопоставление симптомов урологических расстройств с длительностью послеоперационного периода выявило значительное преобладание их в более отдаленные сроки после операции. Так, клинические проявления цистоуретрита (ЦУ) наблюдали у 3 (1,3%) пациенток из числа прооперированных через 1 год; у 15 (6,4%) – через 3 года и у 37 (15,9%) – через 5 лет после операции.
Из 55 пациенток с выявленными урологическими расстройствами 19 (34,5%) больных были после субтотальной ГЭ (1-я группа) и 36 (65,5%) – после тотальной ГЭ (2-я группа). Анализ выраженности урологических нарушений у обследованных больных (55 человек) выявил наивысшую степень страдания у пациенток после тотальной ГЭ с давностью оперативного лечения 5 лет, наименьшая степень диагностирована через 1 год после субтотальной ГЭ.
Определение степени тяжести недержания мочи
В качестве объективных стандартных тестов определения степени тяжести недержания мочи, предложенных Международным обществом по удержанию мочи (International Continence Society (ICS), 1989), женщинам с различными формами недержания мочи (истинное недержание мочи при напряжении, императивное недержание) предложен дневник мочеиспускания, который включает следующие параметры: количество эпизодов недержания мочи за неделю (N-0); количество прокладок, используемых за неделю (N-0); частота дневных (N-4-5) и ночных мочеиспусканий (N-0-1).Отметим, что частота как дневной, так и ночной поллакиурии коррелировала со степенью тяжести урологических расстройств и составила от 5–10 эпизодов мочеиспускания в день и от 1–3 эпизодов мочеиспускания за ночь при легкой степени до 12–15 эпизодов дневной и 5–8 эпизодов ночной поллакиурии при тяжелой степени.
Количество эпизодов недержания мочи при легкой степени составило 5–6 в неделю; количество прокладок не превышало 7,4±1,2 за этот срок. У пациенток со средней степенью тяжести расстройств соответствующие параметры были 14–16 и 12,5±1,1 в неделю. Тяжелая степень страдания обусловила до 30 эпизодов недержания мочи в неделю и, соответственно, 20,2±0,9 прокладки.
Согласно рекомендациям ICS, целесообразно рассматривать уродинамические характеристики соответственно виду недержания мочи: стрессового или императивного, а также при наличии проявления АЦУ без признаков недержания.
Результаты уродинамического исследования представлены в таблице 2. Данные таблицы также указывают на появление качественных изменений процесса мочеиспускания. Так, существенное уменьшение максимального уретрального давления свидетельствует о неполноценности уретрального механизма удержания мочи, что может быть связано как с атрофическими процессами в уретре, так и со снижением тонуса и тургора тканей уретры и парауретральных тканей, а также с изменением анатомического положения
мочеиспускательного канала, которое наблюдалось при опущении стенок влагалища. К тому же существенное изменение функциональной длины уретры, выявленное при стрессовом недержании мочи, значительно ухудшало ситуацию. Давление детрузора практически не отличалось в группе со стрессовым недержанием мочи от такового в контрольных, однако имелось его повышение у больных с императивным недержанием мочи. Обращает на себя внимание достоверно уменьшенный объем мочевого пузыря при первом позыве к акту мочеиспускания у больных с императивным характером недержания мочи.
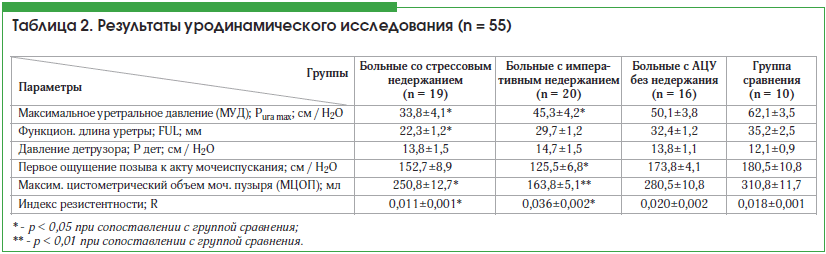
Кроме того, необходимо указать на имевшееся выраженное уменьшение максимального цистометрического объема мочевого пузыря в обеих обследованных группах больных с недержанием, однако в большей степени различия касались больных с императивным характером недержания мочи. Изменения вышеуказанных параметров мочеиспускания обусловило достоверное изменение индекса резистентности уретры. Однако крайне важным является тот факт, что эти изменения носили разнонаправленный характер, что, на наш взгляд, объясняло различный механизм возникновения проблемы удержания мочи.
Анализ уровня половых гормонов
Биохимические процессы, регулируемые в определенной степени половыми стероидами, могут влиять на обменные процессы коллагена, входящего в структуру соединительной ткани связочного аппарата, участвующего в процессе удержания мочи [1, 11, 20, 21]. Исследованиями последних лет, включающими биопсию парауретральной соединительной ткани, показано, что соединительная ткань у женщин, удерживающих мочу, значительно отличается от таковой у женщин с истинным недержанием мочи по количеству и качеству коллагена [8, 11]. Возможно, дефицит эстрогенов вызывает ускорение дегенеративных процессов в соединительной ткани [11–13, 20, 25, 26].Известно, что возникающая гипоэстрогения снижает пролиферативную активность уротелия, уменьшает кровоснабжение тканей, транссудацию жидкости. Следствием этих процессов является изменение количества гликогена, микроценоза и рН в уретре. В результате создаются благоприятные условия для персистирования инфекции и рецидивирования воспалительных процессов в мочевом тракте [1, 12]. Нами выявлено наличие бактериурии у 7 больных из 55, у которых были выявлены урологические расстройства, что составило 12,7% (в группе сравнения инфекции выявлено не было). Морфотип бактерий был представлен кишечной палочкой, стрептококком группы В.
Таким образом, ГЭ способствует развитию урологических проблем. Причем прогрессирование их наблюдается с увеличением длительности послеоперационного периода и расширением объема оперативного вмешательства (тотальная ГЭ).
Сравнивая клинические проявления урологических жалоб и уровень эстрадиола (Е2) у этих пациенток, становится очевидным гормональный генез выявленных изменений. Так, у пациенток с имеющимися симптомами ЦУ средний уровень Е2 составил 85,5±5,8 пг/мл, у пациенток с недержанием мочи – 58,7±3,8 пг/мл, а при императивном недержании – 52,3±3,5 пг/мл, что достоверно ниже содержания гормона у лиц без подобной симптоматики (в группе сравнения Е2 – 150,8±18,5 пг/мл). Кроме того, снижение уровня гормона при ЦУ говорит в пользу атрофического генеза патологии, что наблюдается обычно в постменопаузальном периоде.
Таким образом, урологические расстройства после ГЭ в большей мере обусловлены снижением функциональной активности яичников и являются ступенями одного процесса. Так, первые признаки ЦУ появлялись у оперированных женщин уже через 1 год после хирургического лечения.
Как правило, проявления ЦУ были невыраженными и носили легкий характер. С увеличением длительности послеоперационного периода происходило прогрессирование эстрогензависимого атрофического процесса, что сопровождалось усилением проявления ЦУ, присоединением стрессового и императивного недержания мочи. Это приводит к нарастанию степени тяжести урологических расстройств.
При анализе полученных результатов было выявлено, что достоверное увеличение частоты возникновения урологических проблем у оперированных пациенток происходит через 5,8±0,7 года после ГЭ. После тотальной ГЭ урологические расстройства развиваются в 1,5 раза чаще, чем после субтотальной.
Так как у пациенток после проведения оперативного вмешательства в объеме тотальной или субтотальной ГЭ развиваются изменения в урогенитальном тракте, связанные также с дефицитом эстрогенов, как и в постменопаузальном периоде [11–13, 20], мы считаем правомочным употребление термина «генитоуринарный синдром» применительно к синдрому постгистерэктомии [27].
Гинекологические заболевания после гистерэктомии
Как сообщалось выше, среди всех обследованных больных, перенесших удаление матки, 78 пациенток (33,5%) указали на имевшиеся у них гинекологические проблемы:31 пациентка из 1-й группы и 47 – из 2-й группы.
Исследование наличия и выраженности генитального пролапса позволило выявить опущение культи шейки матки у 2 больных, опущение стенок влагалища с образованием цистоцеле I степени – у 3 больных и цистоцеле II степени – у 4 обследованных нами больных. Всего опущение стенок влагалища диагностировано у 9 пациенток (16,4%). В группе сравнения опущение стенок влагалища выявлено у 1 пациентки (10%). Следовательно, ГЭ ведет к некоторому увеличению частоты опущения стенок влагалища с образованием цистоцеле.
Особенности клинического проявления симптомов со стороны влагалища представлены в таблице 3.
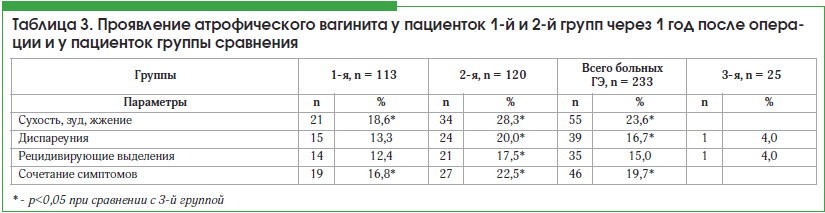
Данные таблицы свидетельствуют о значительном повышении частоты жалоб со стороны генитального тракта у больных, перенесших удаление матки, по сравнению с группой сравнения. Помимо более выраженных изменений у больных после тотальной ГЭ по сравнению с субтотальной, прогрессирование симптоматики происходило параллельно увеличению длительности послеоперационного периода. Через 1 год после операции частота характерных жалоб отмечена у 9 больных из числа прооперированных 233 пациенток (3,9%); через 3 года – у 21 (9,0%), и, наконец, через 5 лет после операции гинекологические жалобы присутствовали у 48 человек (20,6%).
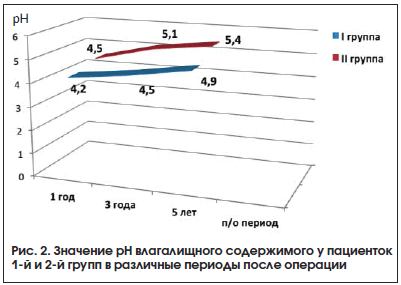
Определение рН влагалищного содержимого позволило выявить некоторое повышение его к 3 году и существенное повышение через 5 лет после операции. Более выраженное ощелачивание содержимого влагалища наблюдалось после тотальной ГЭ. Необходимо отметить, что определение рН влагалища и все дальнейшие исследования генитального тракта проводили у 78 пациенток, указавших на наличие у них соответствующих симптомов.
Динамика изменения уровней рН влагалищного содержимого представлена на рисунке 2.
Значение рН влагалищного содержимого коррелировало со значением зрелости влагалищного эпителия, которое менялось от 50,0 до 70,0 в зависимости от длительности послеоперационного периода и объема операции.
Проведение расширенной кольпоскопии позволило выявить в целом благоприятную картину. Однако с увеличением длительности послеоперационного периода прослеживалось явное увеличение числа больных с признаками атрофического процесса.
Так, истончение эпителиального слоя, подверженность его травматизации и кровоточивости при дотрагивании обнаружены у 8,9% больных через 3 года и у 17,9% через 5 лет после операции. Существенную роль играл и объем оперативного вмешательства: в 1-й группе подобная симптоматика выявлена у 16,1% пациенток, а во 2-й группе – у 34,0% обследованных на данном этапе больных.
Качественная оценка микрофлоры влагалища включала характеристику большинства встречающихся морфотипов бактерий: грамположительные кокки, бактероиды, лактоморфотип, фузобактерии, морфотип гарднереллы, мобилункус, вейлонеллы.
Нормальная микроскопическая картина влагалищного мазка, характеризующаяся преобладанием поверхностных клеток, имеющихся в небольшом количестве промежуточных клеток; микрофлорой, представленной морфотипом лактобацилл, а иногда ассоциации лактобацилл и грамположительных кокков, была выявлена у 20 больных 1-й группы из 31, у которых были выявлены гинекологические расстройства (64,5%), и у 18 пациенток 2-й группы из 47 (38,3%). У оставшихся пациенток в 1-й и 2-й группах (35,5% и 61,7% соответственно) уменьшалось количество поверхностных клеток, появлялись, а в ряде случаев и преобладали парабазальные клетки, уменьшалось число лактобацилл и возрастало количество условно-патогенной микрофлоры.
У части пациенток (42,3%) диагностирована картина, характерная для бактериального вагиноза (БВ). При микроскопии определялось массивное микробное обсеменение – выше 1000 микробных клеток в поле зрения, причем преобладали морфотипы гарднерелл. В то же время повышения числа лейкоцитов не наблюдалось, определялись эпителиальные клетки, а также были выявлены «ключевые» клетки. Посев влагалищного содержимого обнаружил строгие анаэробы (Prevotella, Peptococcus) и гарднереллы. Общий их титр был выше 108 коЕ/мл. У 5 пациенток (6,4%) выявлено увеличение числа лейкоцитов до 25–30 в поле зрения, преобладал морфотип грамположительных кокков. Культуральное исследование выявило рост стрептококка группы В (106 коЕ/мл). Данная ситуация была расценена нами как неспецифическое воспаление – аэробный вагинит.
Отметим, что как бактериальный вагиноз, так и аэробный вагинит значительно чаще наблюдались после тотальной ГЭ (28,8% и 3,2% соответственно в 1-й группе и 53,2% и 8,5% соответственно во 2-й группе).
При определении уровня эстрадиола у пациенток с генитальными проблемами нами выявлено резкое уменьшение его до 69,9±4,0, что достоверно ниже уровня у лиц без симптоматики (150,8±18,5 пг/мл). Зависимость выраженности клинических проявлений со стороны генитального тракта от дефицита эстрогенов позволяет нам рассматривать выявленные клинические симптомы как атрофический вагинит. Статистическая обработка зафиксировала отрицательную корреляционную зависимость сильной степени между уровнем Е2 и проявлением генитальных проблем (r = -0,85) и позволила выявить, что проявление симптоматики со стороны генитального тракта наблюдалось через 4,8 года.
Одновременно нами выявлена корреляционная зависимость между уровнем Е2 и степенью выраженности урогенитальных расстройств (соответственно разработанной нами анкете). Так, легкая степень урологических расстройств соответствует уровню Е2 – 80,2±5,8 пг/мл, средняя степень – 65,8±5,2 пг/мл, при тяжелой степени уровень Е2 равен 54,9±3,8 пг/мл (коэффициент корреляции составил r = - 0,87).
В целом из 83 пациенток с имевшимися генитоуринарными расстройствами последние сочетались с нейровегетативными проявлениями у 79,5% (66 пациенток); у оставшихся 20,5% (17 пациенток) генитоуринарные симптомы наблюдались самостоятельно. Данные симптомы сочетались с другими проявлениями климактерического синдрома, в частности, с нейровегетативными проявлениями у 79,5% пациенток, что указывает на общность этиопатогенетических процессов возникновения и развития синдрома, развивающегося в климаксе естественном и после удаления матки.
Лечение генитоуринарных расстройств
При выборе оптимальной схемы лечения генитоуринарных расстройств мы руководствовались характером предъявляемых жалоб, наличием или отсутствием совокупности признаков климактерического синдрома, некоторых метаболических изменений; возможно имеющимися противопоказаниями, а также отношением пациенток к гормональной терапии. Кроме того, определяющая роль в выборе схемы лечения принадлежала степени выраженности генитоуринарных расстройств.С учетом полученных результатов обследования больных, перенесших ГЭ, а также вышеизложенных принципов выбора терапии виды последней были представлены локальной, системной, сочетанной менопаузальной гормональной терапией (МГТ). Согласно классификации степени тяжести генитоуринарных расстройств к легкой степени отнесены 39 оперированных пациенток. Причем 17 из них имели изолированные жалобы со стороны урогенитального тракта, а оставшиеся 22 больные – сочетание «классических» климактерических симптомов и симптомов со стороны урогенитального тракта. Таким образом, 17 пациенткам была назначена локальная МГТ в виде свечей с эстриолом по 0,5 мг через день. Системная терапия для коррекции как местных, так и системных проявлений синдрома была представлена эстрогенсодержащим препаратом – трансдермальным гелем, содержащим эстрадиол 17-бета 1 г (16 человек); эстроген-гестагенным препаратом, содержащим эстрадиола валерат 2 мг и дидрогестерон 10 мг (6 человек). Выбор того или иного препарата диктовался характером жалоб, наличием или отсутствием дислипидемических проявлений, диффузной доброкачественной патологией молочных желез.
Средняя степень тяжести генитоуринарных расстройств была выявлена у 27 оперированных больных. Препаратами выбора в данном случае были гормональные препараты с некоторой андрогенной активностью, т. к. андрогены в урогенитальном тракте имеют собственные рецепторы и могут благотворно влиять на метаболические процессы в тканях [8]. Таким образом, 21 пациентка получала тиболон, оставшиеся 6 пациенток – эстрогенсодержащий препарат (с учетом симптомов со стороны сердечно-сосудистой системы) – эстрадиола валерат 2 мг. Тиболон – это ткане-селективный регулятор эстрогенной активности. Он подвергается локальному метаболизму в эндометрии, в результате которого образуются три метаболита, проявляющих эстрогенное, прогестагенное и андрогенное свойства, что отличает тиболон от других гормональных препаратов [28]. Выраженная степень генитоуринарных расстройств была выявлена
у 17 оперированных пациенток. В данном случае целесообразным было назначение сочетанной гормональной терапии (местная и системная), а также комбинированной терапии (системная гормональная и негормональная терапия, в частности, М-холинолитик (при проведении исследования мы использовали троспия хлорид)).
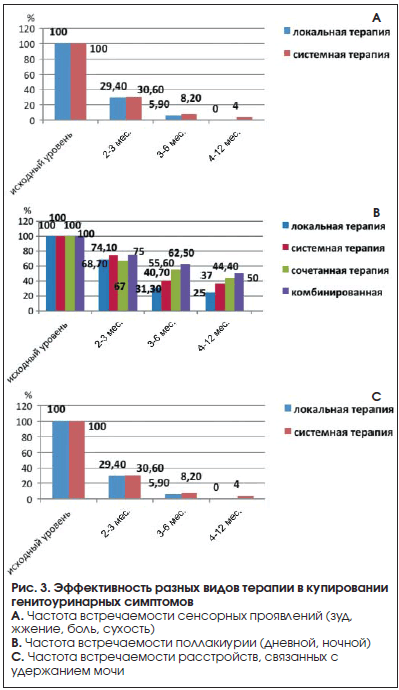
Результаты проводимого лечения представлены на рисунке 3.
Представленные данные свидетельствуют об эффективности гормонотерапии у обследованной категории пациенток. Наибольший эффект наблюдался при сенсорных проявлениях ЦУ и вагинита. Это вполне объяснимо, т. к. указанные симптомы, по данным ряда авторов [13, 20, 29–31], являются в большей степени эстрогензависимыми.
Как видно из рисунка 3, при изолированных сенсорных симптомах назначалась локальная эстрогенотерапия. Подобная ситуация, как правило, наблюдалась при легкой степени генитоуринарных симптомов, что, со своей стороны, также объясняло хороший эффект гормонотерапии. Что касается частого мочеиспускания и, в особенности, проблем удержания мочи, то данные симптомы наблюдались при средней и тяжелой степени генитоуринарных расстройств. Если для купирования сенсорных симптомов большинству больных достаточно 3 мес. лечения, то для более серьезных проявлений этого срока явно недостаточно. Удовлетворительный эффект наблюдался только через 6 мес. лечения (рис. 3).
Интересные данные получены при повторном проведении уродинамического исследования. Анализ полученных при данном исследовании результатов показал, что параметры, определяемые при стрессовом недержании мочи, имели лишь некоторую тенденцию к улучшению, не достигая достоверных различий с исходным состоянием, в отличие от параметров при императивном недержании мочи. Практически по всем показателям, имевшим достоверные различия с группой сравнения,наблюдалось существенное улучшение. И в первую очередь это касалось объема мочевого пузыря при первом ощущении позыва к акту мочеиспускания, максимального цистометрического объема мочевого пузыря и объема выделенной мочи.
При исследовании бактериурии после 6-месячного курса гормонотерапии у 5 из 7 больных последняя выявлена не была. К тому же ни у одной больной с доказанным инфекционным фактором до лечения не отмечено рецидива воспалительного процесса нижнего урологического тракта ни в процессе лечения, ни в течение 6-месячного наблюдения после него.
Таким образом, курс лечения урологических симптомов должен длиться от 3 мес. при легкой степени тяжести до 6 мес. при средней или тяжелой. Однако в ряде случаев, с учетом выраженных проявлений как урологической симптоматики, так и системной климактерической, потребовалось продолжение лечения до 12 мес. и более. В нашем исследовании таких больных было 8 человек. Удлинение курса МГТ позволило добиться исчезновения проблем с удержанием мочи еще у 6 пациенток.
Эффективность гормонотерапии при гиперактивном мочевом пузыре составила 53,8%. Если проанализировать результаты лечения соответственно видам недержания мочи, то становится очевидным хороший эффект терапии при императивном недержании (70%) и недостаточный эффект (36,8%) при стрессовом. Данное наблюдение позволяет сделать вывод о том, что гиперактивный мочевой пузырь в большей степени связан с дистрофическими процессами в стенке мочевого пузыря, а также в его рецепторном аппарате, что сочеталось с гипоэстрогенией у этих больных. Отсутствие эффекта у 6 больных, возможно, связано с наличием так называемого моторного вида императивного недержания, обусловленного в большей мере травмой или неполноценностью различных отделов нервной системы или сочетанием моторного и сенсорного видов императивного недержания.
Низкая эффективность МГТ при стрессовом недержании мочи связана не столько и не только с эстрогендефицитным состоянием, но и с анатомическими изменениями. В частности, стрессовое недержание мочи наблюдалось у всех пациенток с опущением стенок влагалища (9 из 19 человек).
Высокая эффективность гормонотерапии в купировании сенсорного компонента, а также в профилактике рецидива инфекции в мочевом тракте делает целесообразным назначение МГТ всем категориям пациенток с урологическими расстройствами.
Благотворно влияла МГТ и на рН влагалищного содержимого. Так, достоверное снижение показателя наблюдалось через 3 мес. лечения. У 12 больных, имевших высокие показатели рН (среднее среди них 5,2±0,2), через 3 мес. терапии последние нормализовались и составили в среднем 4,3±0,1. Во 2-й группе у 28 больных рН был высоким (5,6±0,2). Статистическое снижение показателя отмечено у них через 6 мес. лечения (рН=4,5±0,1).
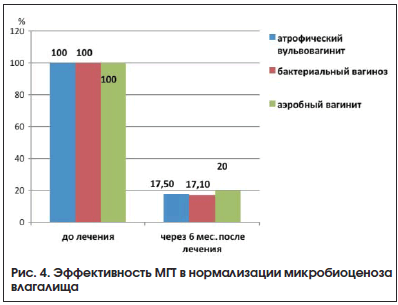
Изменение микробиоценоза влагалища происходило в направлении повышения титра лактобацилл и уменьшения или элиминации условно-патогенной микрофлоры. Данные по изменению микробиоценоза представлены на рисунке 4.
Заключение
Клинический опыт применения тиболона насчитывает более 20 лет. В 2012 г. был зарегистрирован дженерик тиболона – Велледиен 2,5 мг. Велледиен оказывает трофическое действие на слизистую оболочку влагалища, не вызывая пролиферацию эндометрия. Назначение тиболона (Велледиена) возможно с целью лечения эстрогенной недостаточности у женщин после хирургической менопаузы [32].Позитивное влияние гормонотерапии доказывает, что одну из основных ролей в развитии симптоматики со стороны генитального тракта играет снижение уровня эстрадиола, восполнение которого при приеме МГТ и обеспечивает эффект препаратов. Эффективность гормонотерапии как при атрофическом вульвовагините, так и при бактериальном вагинозе говорит в пользу общности их патогенетических механизмов возникновения как единого процесса развития эстрогендефицитного состояния.
Литература
1. Доброхотова Ю.Э., Макаров О.В. Состояние генитального тракта после гистерэктомии // Российский медицинский журнал. 2003. № 2. С. 20 [Dobrohotova Ju.Je., Makarov O.V. Sostojanie genital'nogo trakta posle gisterjektomii // Rossijskij medicinskij zhurnal. 2003. № 2. S. 20 (in Russian)].
2. Гайворонских Д.И., Коваль А.А., Скворцов В.Г. Постгистерэктомический синдром: клинические проявления и методы коррекции // Вестник Российской военно-медицинской академии. 2012. № 4 (40). С. 12–123 [Gajvoronskih D.I., Koval' A.A., Skvorcov V.G. Postgisterjektomicheskij sindrom: klinicheskie projavlenija i metody korrekcii // Vestnik Rossijskoj voenno-medicinskoj akademii. 2012. № 4 (40). S. 12–123 (in Russian)].
3. Херт Г. Оперативная урогинекология / пер. с англ. под ред. Н.А. Лопаткина. М.: ГЭОТАР-МЕД, 2003. С. 33–66 [ Hert G. Operativnaja uroginekologija / per. s angl. pod. redakciej N.A. Lopatkina. M.: GJeOTAR-MED, 2003. S. 33–66 (in Russian)].
4. Хирш X., Кезер О., Икле Ф. Оперативная гинекология / пер. с англ. М.: Гэотар-медицина, 1999. С. 656 [ Hirsh X., Kezer O., Ikle F. Operativnaja ginekologija / per. s angl. M.: Gjeotar-medicina, 1999. S. 656 (in Russian)].
5. Мазо Е.Б., Кривобородов Г.Г. Гиперактивный мочевой пузырь. М.: Вече, 2003. С. 160 [ Mazo E.B., Krivoborodov G.G. Giperaktivnyj mochevoj puzyr'. M.: Veche, 2003. S. 160 (in Russian)].
6. Tyagi S. et al. The overactive bladder: epidemiology and morbidity // Uro. Clin. N. Am. 2006. Vol. 33. P. 433–438.
7. Ильина И.Ю., Доброхотова Ю.Э., Маликова В.О., Чикишева А.А. Особенности мочеиспускания у гинекологических больных // Гинекология. 2013. № 5. Т.15. С. 48–50 [Il'ina I.Ju., Dobrohotova Ju.Je., Malikova V.O., Chikisheva A.A. Osobennosti mocheispuskanija u ginekologicheskih bol'nyh // Ginekologija. 2013. № 5. T.15. S. 48–50 (in Russian)].
8. Ulmsten U. On urogenital ageing // Maturitas. 1995. Vol. 21. P. 163–169.
9. Балан В.Е., Гаджиева З.К. Нарушения мочеиспускания в климактерии и принципы их лечения // Русский медицинский журнал. 2000. № 3. С. 27–31 [Balan V.E., Gadzhieva Z.K. Narushenija mocheispuskanija v klimakterii i principy ih lechenija // Russkij medicinskij zhurnal. 2000. № 3. S. 27–31 (in Russian)].
10. Доброхотова Ю.Э., Фандеева Л.В., Кайфаджян М.М. и др. Комплексный подход к лечению гиперактивного мочевого пузыря у женщин с пролапсом гениталий. Сборник тезисов // Амбулаторно-поликлиническая практика: проблемы и перспективы. 2011. С. 161–165 [Dobrohotova Ju.Je., Fandeeva L.V., Kajfadzhjan M.M. i dr. Kompleksnyj podhod k lecheniju giperaktivnogo mochevogo puzyrja u zhenshhin s prolapsom genitalij. Sbornik tezisov // Ambulatorno-poliklinicheskaja praktika: problemy i perspektivy. 2011. S. 161–165 (in Russian)].
11. Радзинский В.Е. Перинеология. М.: Медицинское информационное агентство, 2006. С. 14–96 [Radzinskij V.E. Perineologija. M.: Medicinskoe informacionnoe agentstvo, 2006. S. 14–96 (in Russian)].
12. Сметник В.П. Медицина климактерия. М.: Литтерра, 2006. С. 848 [Smetnik V.P. Medicina klimakterija. M.: Litterra, 2006. S. 848 (in Russian)].
13. Макаров О.В., Сметник В.П., Доброхотова Ю.Э. Синдром постгистерэктомии. М., 2000. С. 135–167 [Makarov O.V., Smetnik V.P., Dobrohotova Ju.Je. Sindrom postgisterjektomii. M., 2000. S. 135–167 (in Russian)].
14. Доброхотова Ю.Э., Кривобородов Г.Г., Макаров О.В., Мазо Е.Б. и др. Урологические расстройства после гистерэктомии // Российский медицинский журнал. 2003. № 4. С. 29 [Dobrohotova Ju.Je., Krivoborodov G.G., Makarov O.V., Mazo E.B. i dr. Urologicheskie rasstrojstva posle gisterjektomii // Rossijskij medicinskij zhurnal. 2003. № 4. S. 29 (in Russian)].
15. Новиков А.И., Михайличенко В.В., Александров В.П., Куренков А.В. и др. Влияние оперативного доступа на функциональное состояние нижних мочевых путей при гистерэктомии // Андрология и генитальная хирургия. 2008. № 4. С. 21–24 [Novikov A.I., Mihajlichenko V.V., Aleksandrov V.P., Kurenkov A.V. i dr. Vlijanie operativnogo dostupa na funkcional'noe sostojanie nizhnih mochevyh putej pri gisterjektomii // Andrologija i genital'naja hirurgija. 2008.№ 4. S. 21–24 (in Russian)].
16. Петрос П. Женское тазовое дно. Функции, дисфункции и их лечение в соответствии с интегральной теорией. М.: МЕДпресс-информ, 2016. С. 293–332 [Petros Р. Zhenskoe tazovoe dno. Funkcii, disfunkcii i ih lechenie v sootvetstvii s integral'noj teoriej. M.: MEDpress-inform, 2016. S. 293–332 (in Russian)].
17. Chou Y.C., Yu K.J. Entrapped vaginal pessary presented with frequency and urge incontinence // Chin. Med. Assoc. 2003. Vol. 66. Р. 181–183.
18. Glavind K., Tetsche M.S. Sexual function in women before and after suburethral sling operation for stress urinary incontinence: a retrospective questionnaire study // Acta Obstet Gynecol. Scand. 2004. Vol. 83. Р. 965–968.
19. Lukacz E.S., Whitcomb E.L., Lawrence J.M. et al. Are sexual activity and satisfaction affected by pelvic floor disorders? Analysis of a community-based survey // Am J. Obstet Gynecol. 2007. Vol. 197. Р. 88–93.
20. Ильина И.Ю., Доброхотова Ю.Э. Генитальный пролапс: этиология, диагностика, лечение. Учебно-методическое пособие. М., 2011. С. 37 [Il'ina I.Ju., Dobrohotova Ju.Je. Genital'nyj prolaps: jetiologija, diagnostika, lechenie. Uchebno-metodicheskoe posobie. M., 2011. S. 37 (in Russian)].
21. Камоева С.В. Патогенетические аспекты прогнозирования, диагностики и лечения пролапса тазовых органов: Автореф. дисс… докт.мед.наук. М., 2014. С. 257 [ Kamoeva S.V. Patogeneticheskie aspekty prognozirovanija, diagnostiki i lechenija prolapsa tazovyh organov: Avtoref diss… dokt.med.nauk. M., 2014. S. 257 (in Russian)].
22. Hers A.L., Stefanick M.L., Stafferd R.S. National use of postmenopausal hormone therapy: annual trens and response to recent evidence // JAMA. 2004. Vol. 291. P. 47–53.
23. Доброхотова Ю.Э. Менопаузальный синдром. Учебно-методическое пособие. М., 2005. С. 24 [Dobrohotova Ju.Je. Menopauzal'nyj sindrom // Uchebno-metodicheskoe posobie. M., 2005. S. 24 (in Russian)].
24. Ghezzi F., Serati M., Cromi A. et al. Impact of tension-free vaginal tape on sexual function: results of a prospective study // Int. Urogynecol. J. 2006. Vol. 17. Р. 54–59.
25. Гаспаров А.С., Дубинская Е.Д., Бабичева И.А., Лаптева Н.В. и др. Роль дисплазии соединительной ткани в акушерско-гинекологической практике // Казанский медицинский журнал. 2014. Т. 95. № 6. С. 897–904 [Gasparov A.S., Dubinskaja E.D., Babicheva I.A., Lapteva N.V. i dr. Rol' displazii soedinitel'noj tkani v akushersko-ginekologicheskoj praktike // Kazanskij medicinskij zhurnal. 2014. T. 95. № 6. S. 897–904 (in Russian)].
26. Ильина И.Ю., Маликова В.О., Чикишева А.А., Доброхотова Ю.Э. Значимость маркеров распада коллагена в развитии пролапса гениталий в послеоперационном периоде у женщин после гистерэктомии // Вестник Российского государственного медицинского университета. 2011. № 3. С. 52–55 [Il'ina I.Ju., Malikova V.O., Chikisheva A.A., Dobrohotova Ju.Je. Znachimost' markerov raspada kollagena v razvitii prolapsa genitalij v posleoperacionnom periode u zhenshhin posle gisterjektomii // Vestnik Rossijskogo gosudarstvennogo medicinskogo universiteta. 2011. № 3. S. 52–55 (in Russian)].
27. Сметник В.П. Генитоуринарный менопаузальный синдром: новый термин, обоснование, дискуссия // Акушерство и гинекология. 2016. № 4. С. 7–10 [Smetnik V.P. Genitourinarnyj menopauzal'nyj sindrom: novyj termin, obosnovanie, diskussija // Akusherstvo i ginekologija. 2016. № 4. S. 7–10 (in Russian)].
28. Сметник В.П. Тиболон: назад в будущее // Климактерий. 2015. № 2. С. 12-19 [Smetnik V.P. Tibolon: nazad v budushhee // Klimakterij. 2015. № 2. S. 12-19 (in Russian)].
29. Балан В.Е., Ковалева Л.А. Урогенитальный синдром в климактерии. Возможности терапии // Акушерство и гинекология. 2015. № 5. С. 104–108 [Balan V.E., Kovaleva L.A. Urogenital'nyj sindrom v klimakterii. Vozmozhnosti terapii // Akusherstvo i ginekologija. 2015. № 5. S. 104–108 (in Russian)].
30. Горбунова Е.А., Аполихина И.А. Атрофический цистоуретрит как одна из граней генитоуринарного синдрома // Эффективная фармакотерапия. 2015. № 36. С. 32–38 [Gorbunova E.A., Apolihina I.A. Atroficheskij cistouretrit kak odna iz granej genitourinarnogo sindroma // Jeffektivnaja farmakoterapija. 2015. № 36. S. 32–38 (in Russian)].
31. Portman D.J., Gass M.L. Genitourinary syndrome ofmenopause: new terminology for vulvovaginal atrophy from the International Society for the Study of Woman’s Sexual Health and the North American Menopause Society // Maturitas. 2014. Vol. 79. P. 349–354.
32. Инструкция по применению лекарственного препарата для медицинского применения Велледиен, ЛП-001739 [Instrukcija po primeneniju lekarstvennogo preparata dlja medicinskogo primenenija Velledien, LP-001739 (in Russian)].
2. Гайворонских Д.И., Коваль А.А., Скворцов В.Г. Постгистерэктомический синдром: клинические проявления и методы коррекции // Вестник Российской военно-медицинской академии. 2012. № 4 (40). С. 12–123 [Gajvoronskih D.I., Koval' A.A., Skvorcov V.G. Postgisterjektomicheskij sindrom: klinicheskie projavlenija i metody korrekcii // Vestnik Rossijskoj voenno-medicinskoj akademii. 2012. № 4 (40). S. 12–123 (in Russian)].
3. Херт Г. Оперативная урогинекология / пер. с англ. под ред. Н.А. Лопаткина. М.: ГЭОТАР-МЕД, 2003. С. 33–66 [ Hert G. Operativnaja uroginekologija / per. s angl. pod. redakciej N.A. Lopatkina. M.: GJeOTAR-MED, 2003. S. 33–66 (in Russian)].
4. Хирш X., Кезер О., Икле Ф. Оперативная гинекология / пер. с англ. М.: Гэотар-медицина, 1999. С. 656 [ Hirsh X., Kezer O., Ikle F. Operativnaja ginekologija / per. s angl. M.: Gjeotar-medicina, 1999. S. 656 (in Russian)].
5. Мазо Е.Б., Кривобородов Г.Г. Гиперактивный мочевой пузырь. М.: Вече, 2003. С. 160 [ Mazo E.B., Krivoborodov G.G. Giperaktivnyj mochevoj puzyr'. M.: Veche, 2003. S. 160 (in Russian)].
6. Tyagi S. et al. The overactive bladder: epidemiology and morbidity // Uro. Clin. N. Am. 2006. Vol. 33. P. 433–438.
7. Ильина И.Ю., Доброхотова Ю.Э., Маликова В.О., Чикишева А.А. Особенности мочеиспускания у гинекологических больных // Гинекология. 2013. № 5. Т.15. С. 48–50 [Il'ina I.Ju., Dobrohotova Ju.Je., Malikova V.O., Chikisheva A.A. Osobennosti mocheispuskanija u ginekologicheskih bol'nyh // Ginekologija. 2013. № 5. T.15. S. 48–50 (in Russian)].
8. Ulmsten U. On urogenital ageing // Maturitas. 1995. Vol. 21. P. 163–169.
9. Балан В.Е., Гаджиева З.К. Нарушения мочеиспускания в климактерии и принципы их лечения // Русский медицинский журнал. 2000. № 3. С. 27–31 [Balan V.E., Gadzhieva Z.K. Narushenija mocheispuskanija v klimakterii i principy ih lechenija // Russkij medicinskij zhurnal. 2000. № 3. S. 27–31 (in Russian)].
10. Доброхотова Ю.Э., Фандеева Л.В., Кайфаджян М.М. и др. Комплексный подход к лечению гиперактивного мочевого пузыря у женщин с пролапсом гениталий. Сборник тезисов // Амбулаторно-поликлиническая практика: проблемы и перспективы. 2011. С. 161–165 [Dobrohotova Ju.Je., Fandeeva L.V., Kajfadzhjan M.M. i dr. Kompleksnyj podhod k lecheniju giperaktivnogo mochevogo puzyrja u zhenshhin s prolapsom genitalij. Sbornik tezisov // Ambulatorno-poliklinicheskaja praktika: problemy i perspektivy. 2011. S. 161–165 (in Russian)].
11. Радзинский В.Е. Перинеология. М.: Медицинское информационное агентство, 2006. С. 14–96 [Radzinskij V.E. Perineologija. M.: Medicinskoe informacionnoe agentstvo, 2006. S. 14–96 (in Russian)].
12. Сметник В.П. Медицина климактерия. М.: Литтерра, 2006. С. 848 [Smetnik V.P. Medicina klimakterija. M.: Litterra, 2006. S. 848 (in Russian)].
13. Макаров О.В., Сметник В.П., Доброхотова Ю.Э. Синдром постгистерэктомии. М., 2000. С. 135–167 [Makarov O.V., Smetnik V.P., Dobrohotova Ju.Je. Sindrom postgisterjektomii. M., 2000. S. 135–167 (in Russian)].
14. Доброхотова Ю.Э., Кривобородов Г.Г., Макаров О.В., Мазо Е.Б. и др. Урологические расстройства после гистерэктомии // Российский медицинский журнал. 2003. № 4. С. 29 [Dobrohotova Ju.Je., Krivoborodov G.G., Makarov O.V., Mazo E.B. i dr. Urologicheskie rasstrojstva posle gisterjektomii // Rossijskij medicinskij zhurnal. 2003. № 4. S. 29 (in Russian)].
15. Новиков А.И., Михайличенко В.В., Александров В.П., Куренков А.В. и др. Влияние оперативного доступа на функциональное состояние нижних мочевых путей при гистерэктомии // Андрология и генитальная хирургия. 2008. № 4. С. 21–24 [Novikov A.I., Mihajlichenko V.V., Aleksandrov V.P., Kurenkov A.V. i dr. Vlijanie operativnogo dostupa na funkcional'noe sostojanie nizhnih mochevyh putej pri gisterjektomii // Andrologija i genital'naja hirurgija. 2008.№ 4. S. 21–24 (in Russian)].
16. Петрос П. Женское тазовое дно. Функции, дисфункции и их лечение в соответствии с интегральной теорией. М.: МЕДпресс-информ, 2016. С. 293–332 [Petros Р. Zhenskoe tazovoe dno. Funkcii, disfunkcii i ih lechenie v sootvetstvii s integral'noj teoriej. M.: MEDpress-inform, 2016. S. 293–332 (in Russian)].
17. Chou Y.C., Yu K.J. Entrapped vaginal pessary presented with frequency and urge incontinence // Chin. Med. Assoc. 2003. Vol. 66. Р. 181–183.
18. Glavind K., Tetsche M.S. Sexual function in women before and after suburethral sling operation for stress urinary incontinence: a retrospective questionnaire study // Acta Obstet Gynecol. Scand. 2004. Vol. 83. Р. 965–968.
19. Lukacz E.S., Whitcomb E.L., Lawrence J.M. et al. Are sexual activity and satisfaction affected by pelvic floor disorders? Analysis of a community-based survey // Am J. Obstet Gynecol. 2007. Vol. 197. Р. 88–93.
20. Ильина И.Ю., Доброхотова Ю.Э. Генитальный пролапс: этиология, диагностика, лечение. Учебно-методическое пособие. М., 2011. С. 37 [Il'ina I.Ju., Dobrohotova Ju.Je. Genital'nyj prolaps: jetiologija, diagnostika, lechenie. Uchebno-metodicheskoe posobie. M., 2011. S. 37 (in Russian)].
21. Камоева С.В. Патогенетические аспекты прогнозирования, диагностики и лечения пролапса тазовых органов: Автореф. дисс… докт.мед.наук. М., 2014. С. 257 [ Kamoeva S.V. Patogeneticheskie aspekty prognozirovanija, diagnostiki i lechenija prolapsa tazovyh organov: Avtoref diss… dokt.med.nauk. M., 2014. S. 257 (in Russian)].
22. Hers A.L., Stefanick M.L., Stafferd R.S. National use of postmenopausal hormone therapy: annual trens and response to recent evidence // JAMA. 2004. Vol. 291. P. 47–53.
23. Доброхотова Ю.Э. Менопаузальный синдром. Учебно-методическое пособие. М., 2005. С. 24 [Dobrohotova Ju.Je. Menopauzal'nyj sindrom // Uchebno-metodicheskoe posobie. M., 2005. S. 24 (in Russian)].
24. Ghezzi F., Serati M., Cromi A. et al. Impact of tension-free vaginal tape on sexual function: results of a prospective study // Int. Urogynecol. J. 2006. Vol. 17. Р. 54–59.
25. Гаспаров А.С., Дубинская Е.Д., Бабичева И.А., Лаптева Н.В. и др. Роль дисплазии соединительной ткани в акушерско-гинекологической практике // Казанский медицинский журнал. 2014. Т. 95. № 6. С. 897–904 [Gasparov A.S., Dubinskaja E.D., Babicheva I.A., Lapteva N.V. i dr. Rol' displazii soedinitel'noj tkani v akushersko-ginekologicheskoj praktike // Kazanskij medicinskij zhurnal. 2014. T. 95. № 6. S. 897–904 (in Russian)].
26. Ильина И.Ю., Маликова В.О., Чикишева А.А., Доброхотова Ю.Э. Значимость маркеров распада коллагена в развитии пролапса гениталий в послеоперационном периоде у женщин после гистерэктомии // Вестник Российского государственного медицинского университета. 2011. № 3. С. 52–55 [Il'ina I.Ju., Malikova V.O., Chikisheva A.A., Dobrohotova Ju.Je. Znachimost' markerov raspada kollagena v razvitii prolapsa genitalij v posleoperacionnom periode u zhenshhin posle gisterjektomii // Vestnik Rossijskogo gosudarstvennogo medicinskogo universiteta. 2011. № 3. S. 52–55 (in Russian)].
27. Сметник В.П. Генитоуринарный менопаузальный синдром: новый термин, обоснование, дискуссия // Акушерство и гинекология. 2016. № 4. С. 7–10 [Smetnik V.P. Genitourinarnyj menopauzal'nyj sindrom: novyj termin, obosnovanie, diskussija // Akusherstvo i ginekologija. 2016. № 4. S. 7–10 (in Russian)].
28. Сметник В.П. Тиболон: назад в будущее // Климактерий. 2015. № 2. С. 12-19 [Smetnik V.P. Tibolon: nazad v budushhee // Klimakterij. 2015. № 2. S. 12-19 (in Russian)].
29. Балан В.Е., Ковалева Л.А. Урогенитальный синдром в климактерии. Возможности терапии // Акушерство и гинекология. 2015. № 5. С. 104–108 [Balan V.E., Kovaleva L.A. Urogenital'nyj sindrom v klimakterii. Vozmozhnosti terapii // Akusherstvo i ginekologija. 2015. № 5. S. 104–108 (in Russian)].
30. Горбунова Е.А., Аполихина И.А. Атрофический цистоуретрит как одна из граней генитоуринарного синдрома // Эффективная фармакотерапия. 2015. № 36. С. 32–38 [Gorbunova E.A., Apolihina I.A. Atroficheskij cistouretrit kak odna iz granej genitourinarnogo sindroma // Jeffektivnaja farmakoterapija. 2015. № 36. S. 32–38 (in Russian)].
31. Portman D.J., Gass M.L. Genitourinary syndrome ofmenopause: new terminology for vulvovaginal atrophy from the International Society for the Study of Woman’s Sexual Health and the North American Menopause Society // Maturitas. 2014. Vol. 79. P. 349–354.
32. Инструкция по применению лекарственного препарата для медицинского применения Велледиен, ЛП-001739 [Instrukcija po primeneniju lekarstvennogo preparata dlja medicinskogo primenenija Velledien, LP-001739 (in Russian)].

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
