Влияние вискосапплиментарной терапии с использованием гиалуроната натрия на потребность в эндопротезировании коленных суставов при остеоартрозе
РМЖ. №25 от 30.11.2017 стр. 1898-1904
Рубрика:
Ревматология
Остеоартроз (ОА) – самое распространенное заболевание суставов у человека. В последние годы все более широкое применение находят препараты гиалуроновой кислоты (ГК) для внутрисуставного введения.
Цель исследования: изучение влияния вискосапплиментарной терапии препаратом ГК Ферматрон на потребность в эндопротезировании коленных суставов у пациентов с ОА.
Материал и методы: проведен ретроспективный анализ медицинской документации пациентов с верифицированным диагнозом ОА за период с 2013 по 2015 г. Для анализа были сформированы 2 группы пациентов (основная – 388 человек (295 женщин и 93 мужчины) и контрольная – 378 человек (276 женщин и 102 мужчины)). Средний возраст пациентов составил 63,5±9,5 года. Для объективизации полученных данных были выделены 3 возрастные подгруппы: 50–60 лет, 61–70 лет и старше 71 года. Пациенты контрольной группы получали традиционную терапию ОА. Пациенты основной группы дополнительно применяли внутрисуставное введение препарата Ферматрон 1% 2 мл курсами по 3 инъекции в целевой сустав с интервалом в 7 дней. Количество проведенных курсов варьировало от 1 до 3 с интервалами 8–12 мес. Оценка потребности в эндопротезировании суставов проводилась на конец 2015 г.
Результаты: через 3 года в основной группе общее количество пациентов, нуждающихся в эндопротезировании, составило 11,1%, что почти в 2 раза ниже аналогичного показателя в контрольной группе – 21,3 % (р<0,05). Потребность в эндопротезировании у пациентов основной группы, получавших Ферматрон курсами 3-кратно, достоверно ниже во всех возрастных группах по сравнению с контрольной и составляет в возрасте 51–60 лет 10,10% и 21, 65%; в возрасте 61–70 лет – 12,24% и 33,3%; в возрасте старше 71 года – 29,17% и 50% соответственно (р<0,05). Для пациентов старше 71 года с IV рентгенологической стадией в основной и контрольной группах различия недостоверны.
Выводы: внутрисуставное введение препарата ГК Ферматрон 1% 2 мл может применяться для лечения пациентов всех возрастных групп с ОА коленных суставов не только с целью модификации симптомов заболевания, но и для отдаления сроков эндопротезирования суставов. При этом наилучший эффект от проводимой терапии отмечается при повторении курсов с интервалами от 8 до 12 мес.
Ключевые слова: остеоартроз, коленные суставы, вискосапплиментарная терапия, Ферматрон, потребность в эндопротезировании.
Для цитирования: Беляева Е.А., Авдеева О.С. Влияние вискосапплиментарной терапии с использованием гиалуроната натрия на потребность в эндопротезировании коленных суставов при остеоартрозе. РМЖ. Медицинское обозрение. 2017;25(25):1898-1904.
Цель исследования: изучение влияния вискосапплиментарной терапии препаратом ГК Ферматрон на потребность в эндопротезировании коленных суставов у пациентов с ОА.
Материал и методы: проведен ретроспективный анализ медицинской документации пациентов с верифицированным диагнозом ОА за период с 2013 по 2015 г. Для анализа были сформированы 2 группы пациентов (основная – 388 человек (295 женщин и 93 мужчины) и контрольная – 378 человек (276 женщин и 102 мужчины)). Средний возраст пациентов составил 63,5±9,5 года. Для объективизации полученных данных были выделены 3 возрастные подгруппы: 50–60 лет, 61–70 лет и старше 71 года. Пациенты контрольной группы получали традиционную терапию ОА. Пациенты основной группы дополнительно применяли внутрисуставное введение препарата Ферматрон 1% 2 мл курсами по 3 инъекции в целевой сустав с интервалом в 7 дней. Количество проведенных курсов варьировало от 1 до 3 с интервалами 8–12 мес. Оценка потребности в эндопротезировании суставов проводилась на конец 2015 г.
Результаты: через 3 года в основной группе общее количество пациентов, нуждающихся в эндопротезировании, составило 11,1%, что почти в 2 раза ниже аналогичного показателя в контрольной группе – 21,3 % (р<0,05). Потребность в эндопротезировании у пациентов основной группы, получавших Ферматрон курсами 3-кратно, достоверно ниже во всех возрастных группах по сравнению с контрольной и составляет в возрасте 51–60 лет 10,10% и 21, 65%; в возрасте 61–70 лет – 12,24% и 33,3%; в возрасте старше 71 года – 29,17% и 50% соответственно (р<0,05). Для пациентов старше 71 года с IV рентгенологической стадией в основной и контрольной группах различия недостоверны.
Выводы: внутрисуставное введение препарата ГК Ферматрон 1% 2 мл может применяться для лечения пациентов всех возрастных групп с ОА коленных суставов не только с целью модификации симптомов заболевания, но и для отдаления сроков эндопротезирования суставов. При этом наилучший эффект от проводимой терапии отмечается при повторении курсов с интервалами от 8 до 12 мес.
Ключевые слова: остеоартроз, коленные суставы, вискосапплиментарная терапия, Ферматрон, потребность в эндопротезировании.
Для цитирования: Беляева Е.А., Авдеева О.С. Влияние вискосапплиментарной терапии с использованием гиалуроната натрия на потребность в эндопротезировании коленных суставов при остеоартрозе. РМЖ. Медицинское обозрение. 2017;25(25):1898-1904.
Effect of viscosupplementary therapy with sodium hyaluronate on the need for the knee replacement in osteoarthrosis
Belyaeva E.A., Avdeeva O.S.
Tula State University, Medical Institute
Osteoarthrosis (OA) is the most common joint disease in humans. In recent years, the use of hyaluronic acid (HA) preparations for intra-articular administration has been increased.
Aim. To study the effect of viscosupplementary therapy with AC "Fermatron" on the need for the knee replacement in patients with osteoarthrosis.
Patients and Methods. A retrospective analysis of medical records of patients with a verified diagnosis of OA for the period from 2013 to 2015 was conducted.
For the analysis 2 groups of patients were formed (the main group -388 people (295 women and 93 men) and the control group-378 people (276 women and 102 men)). The average age of the patients was 63.5 ± 9.5 years. To objectify the data obtained, three age subgroups of 50-60 years old, 61-70 years old and over 71 years old, were identified. Patients of the control group received traditional OA therapy. Patients of the main group additionally received the intra-articular injections of the drug "Fermatron" 1% 2 ml by courses of 3 injections into the target joint with an interval of 7 days. The number of courses varied from one to three with 8-12 months intervals. Assessment of the need for the knee replacement was carried out at the end of 2015.
Results. After three years in the main group, the total number of patients requiring the joint replacement was 11.1%, which was almost two times lower than in the control group - 21.3% (p <0.05). The need for the joint replacement in the patients of the main group who received the "Fermatron" by three times courses is significantly lower in all age groups than in the control group, and it amounts to correspondingly 10.10% and 21, 65% at the age of 51-60 years; 12.24% and 33.3% at the age of 61-70 years; 29.17% and 50% (p <0.05) at the age of 71 years. For patients older than 71 years with IV radiographic stage in the main and control groups, the differences are not reliable.
Conclusions. Intra-articular administration of the drug "Fermatron" 1% 2 ml can be used to treat patients of all age groups with OA of knee joints, not only to modify the symptoms of the disease, but also to delay the joint replacement. In this case, the best effect of the therapy is observed when the courses are repeated at intervals of 8 to 12 months.
Key words: osteoarthrosis, knee joints, viscosupplementary therapy, "Fermatron", need for the joint replacement
For citation: Belyaeva E.A., Avdeeva O.S. Effect of viscosupplementary therapy with sodium hyaluronate on the need for the knee replacement in osteoarthrosis // RMJ. 2017. № 25. P. 1898–1904.
Belyaeva E.A., Avdeeva O.S.
Tula State University, Medical Institute
Osteoarthrosis (OA) is the most common joint disease in humans. In recent years, the use of hyaluronic acid (HA) preparations for intra-articular administration has been increased.
Aim. To study the effect of viscosupplementary therapy with AC "Fermatron" on the need for the knee replacement in patients with osteoarthrosis.
Patients and Methods. A retrospective analysis of medical records of patients with a verified diagnosis of OA for the period from 2013 to 2015 was conducted.
For the analysis 2 groups of patients were formed (the main group -388 people (295 women and 93 men) and the control group-378 people (276 women and 102 men)). The average age of the patients was 63.5 ± 9.5 years. To objectify the data obtained, three age subgroups of 50-60 years old, 61-70 years old and over 71 years old, were identified. Patients of the control group received traditional OA therapy. Patients of the main group additionally received the intra-articular injections of the drug "Fermatron" 1% 2 ml by courses of 3 injections into the target joint with an interval of 7 days. The number of courses varied from one to three with 8-12 months intervals. Assessment of the need for the knee replacement was carried out at the end of 2015.
Results. After three years in the main group, the total number of patients requiring the joint replacement was 11.1%, which was almost two times lower than in the control group - 21.3% (p <0.05). The need for the joint replacement in the patients of the main group who received the "Fermatron" by three times courses is significantly lower in all age groups than in the control group, and it amounts to correspondingly 10.10% and 21, 65% at the age of 51-60 years; 12.24% and 33.3% at the age of 61-70 years; 29.17% and 50% (p <0.05) at the age of 71 years. For patients older than 71 years with IV radiographic stage in the main and control groups, the differences are not reliable.
Conclusions. Intra-articular administration of the drug "Fermatron" 1% 2 ml can be used to treat patients of all age groups with OA of knee joints, not only to modify the symptoms of the disease, but also to delay the joint replacement. In this case, the best effect of the therapy is observed when the courses are repeated at intervals of 8 to 12 months.
Key words: osteoarthrosis, knee joints, viscosupplementary therapy, "Fermatron", need for the joint replacement
For citation: Belyaeva E.A., Avdeeva O.S. Effect of viscosupplementary therapy with sodium hyaluronate on the need for the knee replacement in osteoarthrosis // RMJ. 2017. № 25. P. 1898–1904.
Представлены результаты исследования влияния вискосапплиментарной терапии препаратом гиалуроновой кислоты Ферматрон на потребность в эндопротезировании коленных суставов у пациентов с остеоартрозом. Показано, что внутрисуставное введение препарата Ферматрон может применяться для лечения пациентов всех возрастных групп с остеоартрозом коленных суставов, наилучший эффект отмечается при повторении курсов с интервалами от 8 до 12 мес.
Введение
Остеоартроз (ОА) (или остеоартрит) – самое распространенное заболевание суставов у человека. Это вторая основная причина инвалидизации пожилых пациентов после патологии сердечно-сосудистой системы. В России ОА страдают 13% взрослого населения, что составляет около 14 млн человек [1].Термином «остеоартроз» обозначают гетерогенную группу заболеваний со схожими морфологическими признаками и рентгенологическими изменениями. ОА редко развивается у лиц моложе 40 лет и может поражать любой из 200 синовиальных суставов. При этом в патологический процесс вовлекаются все структурные компоненты сустава: хрящ, субхондральная кость, синовиальная оболочка, суставная капсула, связки, периартикулярные мышцы. Наиболее часто патологические изменения происходят в тазобедренных, коленных суставах, дистальных межфаланговых суставах кисти, запястно-пястном суставе первого пальца кисти, первом плюснефаланговом суставе и в дугоотростчатых суставах шейного и поясничного отделов позвоночника [2, 3].
Разные формы ОА имеют сходные клинические проявления – это боль в суставе, связанная с нагрузкой, кратковременная скованность и тугоподвижность после пребывания в статичной позе, крепитация (хруст) при движениях в суставе. Возможна также дефигурация сустава за счет отека мягких периартикулярных тканей или небольшого выпота (типично для коленных суставов). В поздних стадиях могут определяться деформация сустава, его нестабильность и атрофия мышц в области пораженного сустава. При рентгенологическом исследовании у больных с ОА выявляются такие общие признаки, как сужение суставной щели, субхондральный остеосклероз, кисты, остеофиты по краям суставных поверхностей.
При ОА последовательно происходят следующие патоморфологические изменения: появление микротрещин, потеря гладкости хряща, фрагментация суставного хряща, обнажение субхондральной кости и ее кистозная перестройка, формирование остеофитов и прогрессирование субхондрального склероза.
В патогенезе заболевания ведущую роль играют матриксные металлопротеиназы и аггреканазы – ферменты, вызывающие деградацию хряща. Эти ферменты стимулируются провоспалительными цитокинами, в т. ч. ИЛ-1 и адипокинами (адипонектин, резистин и др.), что иллюстрирует значение воспаления в развитии ОА [2, 3].
ОА относится к заболеваниям, прогрессирующим во времени, но при назначении своевременной адекватной терапии процесс может стабилизироваться, усугубления нарушений функциональной способности суставов не произойдет.
Поскольку ОА поражает преимущественно пожилых людей, имеющих массу других заболеваний (со стороны сердечно-сосудистой системы, почек, желудочно-кишечного тракта и др.), подход к терапии этих больных должен быть взвешенным и отвечать самым строгим требованиям безопасности.
Современная терапия ОА направлена на замедление темпов прогрессирования деструктивных изменений в суставе, купирование болевого синдрома, сохранение функции суставов. Для этого используется целый комплекс медикаментозных и немедикаментозных методов лечения.
Среди немедикаментозных методов предлагается обучение больных в школах здоровья, контроль массы тела, ортезирование, физические упражнения, физиотерапевтические методы лечения.
В качестве медикаментозной терапии традиционно применяются нестероидные противовоспалительные препараты (НПВП) для быстрого облегчения боли и подавления воспаления, внутрисуставное введение глюкокортикостероидов (ГКС) при реактивных синовитах коленного сустава, периартикулярные блокады с ГКС при энтезитах, теносиновитах, бурситах, противовоспалительные препараты медленного действия (хондроитина сульфат, глюкозамина сульфат, неомыляемые жиры авокадо и сои, диацереин) [4].
Проблемы использования НПВП у пожилых пациентов с полиморбидностью связаны с множеством специфических побочных эффектов в отношении сердечно-сосудистой системы (повышение кардиоваскулярного риска, прогрессирование хронической сердечной недостаточности, дестабилизация артериального давления), почек (прогрессирование хронической болезни почек, развитие интерстициального нефрита) и ЖКТ (эрозивно-язвенные поражения верхних отделов ЖКТ, повышение риска кровотечений). Кроме того, длительное применение неселективных НПВП может способствовать прогрессированию деструкции суставного хряща и усугублять клинические проявления ОА [5].
В последние годы все более широкое применение находят препараты гиалуроновой кислоты (ГК) для внутрисуставного введения. Они рекомендованы к применению Американской коллегией ревматологов, Европейской антиревматической лигой, Международным обществом по изучению ОА для уменьшения болевого синдрома и улучшения функции коленных суставов как метод, обладающий высокой степенью безопасности при правильном техническом проведении процедуры внутрисуставного введения препарата [6, 7].
Сегодня ГК достаточно широко применяется в различных областях медицины, фармакологии и косметологии. История создания фармакологических препаратов на основе ГК восходит к началу прошлого века, когда в 1918 г. П. Левин и Дж. Лопес-Суарес выделили из стекловидного тела и пуповинной крови полисахарид, состоящий из глюкозамина и глюкуроновой кислоты с примесью небольшого количества сульфатированных цепей. Этот полисахарид получил название мукоитинсерной кислоты, сегодня известной как ГК [8].
Лабораторная идентификация ГК была проведена К. Мейером совместно с Дж. Палмером в 1934 г. из стекловидного тела глаза быка, что и определило название кислоты (от греч. hyalos – стекловидный).
Первый опыт практического применения ГК связан с именем выдающего советского врача Н.Ф. Гамалеи, который впервые в мировой медицине в 1943 г. использовал регенераторные свойства ГК в повязках для обмороженных красноармейцев в военно-полевом госпитале № 1321. Источником ГК для препарата, названного впоследствии «Регенератор», была пуповинная кровь [8]. В тот период не были известны ни микро-, ни макромолекулярные свойства, ни формула молекулы, ни механизмы действия ГК, но уже появился первый опыт ее применения для восстановления поврежденных тканей.
Интерес к медицинскому применению ГК возрастал с середины 1960-х гг., когда были предприняты первые попытки синтеза гиалуроната натрия в лабораториях Японии, Швеции, США.
В 1981 г. комиссия IUPAC по номенклатуре полисахаридов рекомендовала вместо термина «гиалуроновая кислота» применять либо точное указание соли «гиалуронат натрия», либо без уточнения катиона использовать термин «гиалуронан», т. к. экстракция природной ГК приводит к выделению ее в форме соли. За рубежом первые образцы гиалуроната натрия с молекулярной массой более 1,0 млн Да и достаточно высокой степенью очистки были получены в 1968–1970 гг. методом экстракции из биоматериалов. Е. Балац в 1979 г. впервые ввел термин «вискохирургия», он же обосновал применение гиалуронана в офтальмологии и артрологии. В конце 1980-х гг. в Японии и Канаде были одобрены для клинического применения первые коммерческие продукты гиалуронана [8].
В настоящее время на российском фармакологическом рынке присутствуют две основные группы препаратов ГК. Первая группа – это препараты гиалуроната натрия (гиалуронаны) с молекулярной массой не более 4000–5000 кДа, содержащие прямые полимерные цепи из N-ацетилглюкозамина и глюкуроновой кислоты, образующие в растворителе петли случайной формы. Вторая группа – это гиланы, содержащие поперечно сшитые молекулы гиалуронана с высоким молекулярным весом – до 6000 кДа и гелеобразной консистенцией.
Наибольшее применение в клинической практике нашли производные ГК с линейной структурой молекул и молекулярной массой от 500 до 5000 кДа и периодом полувыведения до 17 ч [9].
Обоснованием применения ГК для лечения ОА является ее биологическая роль, заключающаяся в том, что молекулы ГК необходимы для построения хрящевого матрикса и являются главным компонентом синовиальной жидкости, отвечающим за ее вязкоэластические свойства. В норме содержание ГК в суставной жидкости составляет 2,5–3,5 мг/мл, а средняя молекулярная масса ее молекулы – 3140 кДа. При ОА происходят снижение концентрации ГК, уменьшение размера ее молекул, что в результате приводит к нарушению строения коллагенового матрикса хряща и прогрессирующим деструктивным изменениям.
Со временем стало понятно, что ГК не только является «строительным материалом», но и обладает другими важными свойствами. Известно, что гиалуронат натрия обладает противовоспалительным и аналгетическим действием, реализующимся вследствие снижения концентрации провоспалительных цитокинов (ИЛ-1, ФНО и др.) в суставе, подавления активности металлопротеиназ, снижения продукции брадикинина и прямого влияния на ноцицептивную систему. Важнейшим эффектом экзогенного гиалуронана является стимуляция синтеза эндогенной ГК и протеогликанов. Механизмы репаративного действия гиалуронана, вероятно, связаны как с обеспечением через СD44-рецептор хемотаксиса мезенхимальных стволовых клеток в зону репарации хряща, так и с наращиванием синовиоцитами экспрессии факторов роста: соединительнотканного, трансформирующего фактора роста бета-1 и васкулярно-эндотелиального фактора роста [10–12].
Во многих клинических исследованиях показано снижение болевого синдрома на фоне применения производных ГК. Продолжительность эффекта от лечения препаратами гиалуронана составляет, по данным разным авторов, от 6 до 24 нед., а иногда и до 12 мес. [13, 14].
Учитывая весь спектр эффектов препаратов ГК, можно предположить, что их применение влияет на течение ОА, способствуя стабилизации процесса и отдаляя сроки эндопротезирования суставов у больных с III и IV рентгенологическими стадиями по Kellgren – Lawrence.
Хирургическое лечение при ОА показано в случае выраженных функциональных нарушений и при сохраняющемся болевом синдроме, на фоне проводимой медикаментозной и немедикаментозной терапии. Несмотря на хорошие результаты эндопротезирования тазобедренных и коленных суставов, увеличение сроков функционирования протезов, сегодня одной из основных целей терапии ОА является максимальное отдаление сроков эндопротезирования в связи с высокой вероятностью осложнений при повторном оперативном вмешательстве на протезированном суставе. Кроме того, удовлетворенность пациентов результатами хирургического лечения значительно выше при эндопротезировании тазобедренного сустава по сравнению с коленным.
Цель исследования
Нами было предпринято ретроспективное исследование с целью изучения влияния вискосапплиментарной терапии препаратом ГК Ферматрон на потребность в эндопротезировании коленных суставов у пациентов с ОА.Материал и методы
Проведен ретроспективный анализ медицинской документации (историй болезни и амбулаторных карт) пациентов городского ревматологического центра городской больницы № 9 г. Тулы за 3-летний период – с 2013 по 2015 г. Все пациенты имели верифицированный диагноз ОА, соответствующий критериям АCR (1987): боль в коленных суставах, утренняя скованность <30 мин; рентгенологически II–IV стадии по Kellgren – Lawrence.Для анализа были сформированы 2 группы пациентов (основная и контрольная), сопоставимые по возрасту, полу, рентгенологическим стадиям ОА. Количество пациентов в основной группе – 388 человек, в контрольной – 378 человек. Средний возраст пациентов составил 63,5±9,5 года, распределение по полу: в основной группе женщин – 295 (76%), мужчин – 93 (24%); в контрольной группе: женщин – 276 (73%), мужчин – 102 (27%). Преобладание женщин в группах исследования обусловлено более высокой распространенностью у них гонартроза по сравнению с мужчинами. Для объективизации полученных данных в каждой группе были выделены 3 возрастные подгруппы: 50–60 лет (в среднем 55,6±2,4 года), 61–70 лет (65,8±4,2) и старше 71 года (74,5±3,1).
Пациенты контрольной группы получали традиционную терапию ОА: НПВП, симптом-модифицирующие средства медленного действия, ФТЛ. Пациенты основной группы наряду с традиционной терапией применяли внутрисуставное введение препарата Ферматрон 1% 2 мл (молекулярный вес гиалуроната натрия – 1 млн Да) курсами по 3 инъекции в целевой сустав с интервалом в 7 дней.
Ферматрон – препарат гиалуроната натрия четвертого поколения. При его производстве учтены недостатки предыдущих поколений препаратов. Изготовлен путем бактериальной ферментации, стерилизация производится по методу микромембранной фильтрации с сохранением максимальной нативности препарата, рН стабилизация проводится фосфатным буферным раствором, идентичным человеческому, поддерживает рН 7,4. Имеет оптимальный молекулярный вес 1,1–2,2 млн Да. Весь цикл производства от синтеза до упаковки проходит на заводе-изготовителе в Великобритании. На каждом этапе производства осуществляется строгий контроль качества препарата.
Количество проведенных курсов варьировало от 1 до 3 с интервалами 8–12 мес. Все пациенты, получавшие Ферматрон, были распределены по подгруппам в зависимости от количества курсов внутрисуставных инъекций.
Потребность в эндопротезировании через 3 года определялась по установленным показаниям: необратимое нарушение функции сустава, некупируемый интенсивный болевой синдром, нарушающий ночной сон [15].
Статистический анализ проводился с использованием критерия Хи-квадрат, отличительная особенность которого заключается в непараметричности, т. е. независимости от формы распределения. Статистически значимыми считались различия при р<0,05.
Результаты
В обеих исследуемых группах присутствовали пациенты со II–IV рентгенологическими стадиями ОА по Kellgren – Lawrence. Преобладали больные с тяжелым течением ОА III и IV рентгенологической стадии, наибольшую по численности группу составили пациенты с III стадией, поскольку именно эта группа больных особенно интересна для анализа, т. к. нуждается в наиболее интенсивной терапии, имеет показания к хирургическому лечению (табл. 1).
Оценка потребности в эндопротезировании суставов проводилась на конец 2015 г. За 3-летний период разные пациенты провели 1, 2 или 3 курса инъекционной терапии препаратом Ферматрон 1% 2 мл. В зависимости от количества курсов терапии они были распределены на 3 группы (табл. 2), для каждой из которых оценивалась потребность в эндопротезировании.
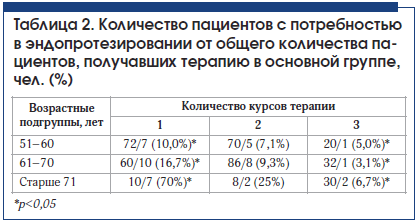
Выяснилось, что 1 курс внутрисуставного введения Ферматрона мало влияет на снижение потребности в эндопротезировании, тогда как 3-кратное повторение курсов лечения ассоциировано со снижением потребности в эндопротезировании во всех возрастных группах, но особенно у пациентов старше 71 года со II и III рентгенологическими стадиями: потребность при 3-кратном проведении курсов лечения Ферматроном оказалась ниже в 10 раз по сравнению с однократным курсом лечения (рис. 1). Высокий процент больных старше 71 года, нуждающихся в эндопротезировании после 1 курса введения Ферматрона, обусловлен преобладанием среди них пациентов с IV рентгенологической стадией. Так, в возрастной группе 51–60 лет потребность в эндопротезировании у больных, которые провели 1 курс внутрисуставного введения Ферматрона, через 3 года составила 10%, а у больных, осуществивших 3 курса лечения, – 5% (p<0,05). В группе 61–70 лет потребность в эндопротезировании у пациентов, которые провели 3 курса лечения Ферматроном, более чем в 5 раз ниже (3,1%), чем у пациентов, получивших 1 курс внутрисуставного введения (16,7%).
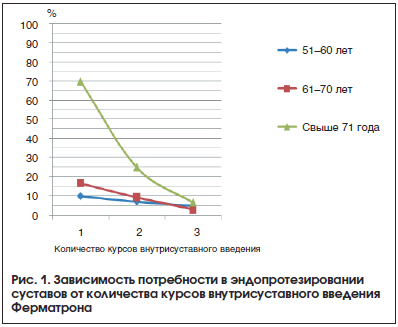
Различия в потребности в эндопротезировании после 1 и 3 курсов терапии достоверны во всех возрастных группах (p<0,05).
При анализе потребности в эндопротезировании через 3 года наблюдения в основной и контрольной группах получено достоверное подтверждение эффективности внутрисуставного введения препарата Ферматрон для снижения потребности в эндопротезировании во всех возрастных группах и при всех рентгенологических стадиях гонартроза. Межгрупповые различия достоверны (табл. 3–5). Так, в основной группе общее количество пациентов, нуждающихся в эндопротезировании через 3 года наблюдения, составило 11,1%, что почти в 2 раза ниже аналогичного показателя в контрольной группе – 21,3 % (р<0,05).
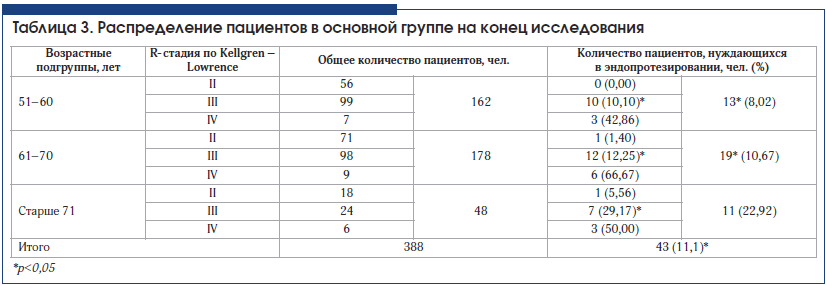
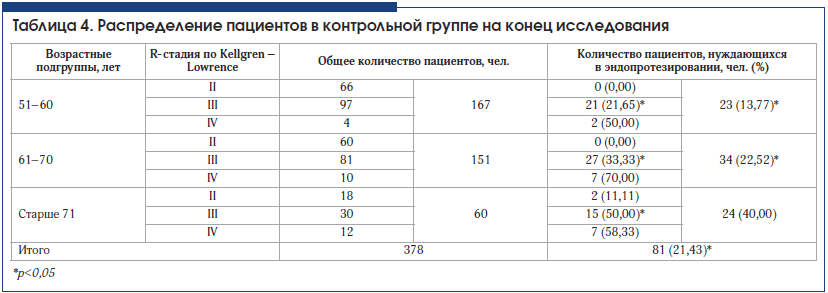
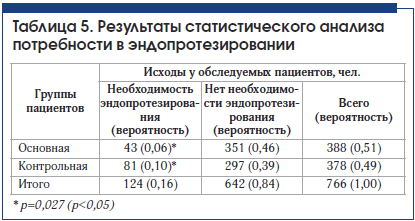
У пациентов со II рентгенологической стадией гонартроза потребность в эндопротезировании возникла в связи с наличием некупируемого болевого синдрома. Эти единичные случаи у больных старше 61 года свидетельствуют об известном феномене несоответствия выраженности рентгенологических изменений клиническим проявлениям ОА. Ожидаемыми были результаты по оценке потребности в эндопротезировании у пациентов в возрасте 71 года и старше, у которых отмечался наибольший стаж заболевания, в этой возрастной категории в целом достоверных различий между основной и контрольной группой не получено. Это можно объяснить присоединением нейропатического компонента хронической боли, а также формированием нестабильности сустава, деформацией конечности, поражением связочного аппарата, развитием тяжелых энтезопатий, изменениями периартикулярных мышц в связи с длительным стажем заболевания.
Наиболее интересны данные, полученные у пациентов всех возрастных групп с III рентгенологической стадией ОА. Потребность в эндопротезировании у пациентов основной группы, получавших Ферматрон, достоверно ниже во всех возрастных группах по сравнению с контрольной и составляет в возрасте 51–60 лет – 10,10% и 21,65%; в возрасте 61–70 лет – 12,24% и 33,3%; в возрасте старше 71 года – 29,17% и 50% соответственно (различия достоверны, р<0,05). Эти различия обусловлены снижением интенсивности боли и расширением объема движений в целевом суставе среди пациентов, получавших Ферматрон.
Обсуждение
Лечение ОА представляет собой сложную задачу, особенно в связи с наличием у подавляющего большинства пациентов коморбидности, осложняющей применение НПВП, парацетамола, наркотических анальгетиков. В связи с этим все большую роль начинают играть препараты для локальной внутрисуставной терапии, в первую очередь – производные ГК.Современные представления о применении гиалуронана в артрологии основаны на утверждении, что вискосапплиментарная терапия эффективнее плацебо уменьшает боль и способствует улучшению функции суставов при минимальном количестве побочных эффектов [15]. Эти эффекты позволяют снижать потребность в эндопротезировании у пациентов с ОА наиболее нагруженных суставов: коленных и тазобедренных.
При этом в одном из метаанализов показано, что улучшение маловероятно у больных старше 65 лет при полной потере суставной щели [16], что согласуется с полученными нами результатами в возрастной группе старше 71 года у пациентов с IV рентгенологической стадией ОА коленных суставов по Kellgren – Lawrence.
Исходя из результатов проведенного исследования, основной целевой группой для проведения вискосапплиментарной терапии являются пациенты моложе 70 лет со II и III рентгенологическими стадиями ОА по Kellgren – Lawrence. У пациентов с IV рентгенологической стадией ОА коленных суставов потребность в эндопротезировании тоже снижается, но в меньшей степени – в связи с тяжелыми структурными изменениями самого сустава и периартикулярных тканей, также являющихся источником стойкого болевого синдрома.
Достоинствами инъекционной терапии с применением гиалуронана считаются: направленное воздействие препарата непосредственно в очаге поражения, противовоспалительное и вероятное структурно-модифицирующее действие и длительный период последействия после окончания курса внутрисуставной терапии [17, 18]. Применение препаратов ГК обеспечивает результаты, которых ожидают пациенты от проведения лечения ОА: уменьшение боли и тугоподвижности в суставе. Это способствует расширению двигательной активности, повышению общего тонуса и позволяет отодвинуть сроки эндопротезирования сустава либо отказаться от его проведения.
Несмотря на большой опыт по проведению операций эндопротезирования суставов и хорошие отдаленные результаты оперативного лечения, в ряде случаев возможно возникновение таких осложнений, как вывих имплантата, перелом ножки эндопротеза, миграция компонентов эндопротеза, перипротезные переломы, послеоперационные перипротезные инфекции, повреждение собственной связки надколенника, тромбоэмболии, стойкие некупируемые послеоперационные гоналгии [19, 20]. Поэтому хирургическое лечение должно проводиться только после констатации неэффективности всех видов консервативной терапии.
Применение препаратов ГК на этапе консервативного лечения обусловлено специфическими механизмами действия экзогенного гиалуроната: способностью снижать концентрацию провоспалительных медиаторов, влиять на функциональную активность иммунных клеток, повышать продукцию протеогликанов и эндогенной ГК [21–23], что обеспечивает клиническую эффективность гиалуронанов.
С учетом полученных результатов исследования внутрисуставное введение препарата ГК Ферматрон 1% 2 мл может применяться для лечения пациентов всех возрастных групп с ОА коленных суставов не только с целью модификации симптомов заболевания, но и для отдаления сроков эндопротезирования суставов. При этом наилучший эффект от проводимой терапии отмечается при неоднократном повторении курсов внутрисуставного введения Ферматрона с интервалами от 8 до 12 мес.
Безопасность, хорошая переносимость и высокая эффективность вискосапплиментарной терапии свидетельствуют о значимости этого метода лечения для улучшения прогноза у пациентов с ОА крупных суставов.
Литература
1. Галушко Е.А., Большакова Т.Б., Виноградова И.Б., Иванова О.Н., Лесняк О.М. Структура ревматических заболеваний среди взрослого населения России по данным эпидемиологического исследования // Научно-практическая ревматология. 2009. № 1. С. 1–17 [Galushko E.A., Bol'shakova T.B., Vinogradova I.B., Ivanova O.N., Lesnyak O.M. Struktura revmaticheskih zabolevanij sredi vzroslogo naseleniya Rossii po dannym ehpidemiologicheskogo issledovaniya // Nauchno-prakticheskaya revmatologiya. 2009. № 1. S. 1–17 (in Russian)].
2. Ревматология: клинические рекомендации. М.: ГЭОТАР-Медиа, 2010. 752 с. [Revmatologiya: klinicheskie rekomendacii. M.: GEHOTAR-Media, 2010. 752 s. (in Russian)].
3. Ревматические заболевания в 3-х тт. Т. II. Заболевания костей и суставов: руководство / под ред. Д.Х. Клиппела и др. М.: ГЭОТАР-Медиа, 2014. 520 с. [Revmaticheskie zabolevaniya v 3 t. T. II. Zabolevaniya kostej i sustavov: rukovodstvo / pod red. D.H. Klippela i dr. M.: GEHOTAR-Media, 2014. 520 s. (in Russian)].
4. Hochberg M.C., Altman R.D. et al. ACR 2012 recommendations for the use of nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip and knee //Arthritis Care Res. 2012. Vol. 64 (4). P. 465–474.
5. Каратеев А.Е., Насонов Е.Л. и др. Рациональное применение НПВП в клинической практике. М.: ИМА-ПРЕСС, 2015. 36 с. [Karateev A.E., Nasonov E.L. i dr. Racional'noe primenenie NPVP v klinicheskoj praktike. M.: IMA-PRESS, 2015. 36 s. (in Russian)].
6. Balazs E.A. Viscosupplementation for treatment of osteoarthritis: from initial discovery to current status and resalts // Surg. Technol. Int. 2004. Vol. 12. P. 278–289.
7. Moreland L.W. Intra-articular hyaluronan (hyaluronic acid) and hylans for the treatment of osteoarthritis: mechanism of action // Arthritis Res. Ther. 2003. Vol. 5(2). P. 5–9.
8. Федорищев И.А. Гиалуроновая кислота. T. I. Тула: Изд-во ТулГУ, 2011. 238 c. [Fedorishchev I.A. Gialuronovaya kislota. T. I. Tula: Izd-vo TulGU, 2011. 238 s. (in Russian)].
9. Divire J.G., Zazulac B.T., Hevett T.E. Viscosupplementation for knee osteoarthritis: a systematic review // Clin Orthop Relot Res. 2007. Vol. 455. P. 113–122.
10. Balazs E.A., Denlinger J.I. Viscosupplementation: a neu concept in the treatment of osteoarthritis // J Rheumatol. 1993. Vol. 20(39). P. 3–9.
11. Takahashi K., Goomer R.S., Harwood F. et al. The effects of hyaluronan on matrix metalloproteinase-3 (MMP-3), interleukin-1 beta (IL-lbeta), and tissue inhibitor of metalloproteinase-1 (TINP-1) gene expression during the development of osteoarthritis // Osteoarthr Cartilage 1999. Vol. 7. P. 182–190.
12. Comer J.S., Kincaid S.A., Baird A.N. et al. Immunolocalization of stromelysin, tumor necrosis factor (TNF) alpha, and TNF receptors in atrophied canine articular cartilage treated with hyaluronic acid and transforming growth factor beta // Am J Vet Res. 1996. Vol. 57. P. 1488–1496.
13. Arrich J., Piribauer F., Mad P. et al. Intra-articular hyaluronic acid for the treatment on. osteoarthritis of the knee: systematic review and meta-analysis. CMAJ. 2005. Vol. 172. P. 1039–1043.
14. Bannuru R.R., Natov N.S., Dasi U.R. et al. Therapeutic trajectory following intra-articular hyaluronic acid injection in knee osteoarthritis-meta-analusis // Osteorthr Cartilage. 2011. Vol. 19. P. 611–619.
15. Клинические рекомендации. Остеоартрит. Диагностика и ведение больных остеоартритом коленных и тазобедренных суставов / под ред. О.М. Лесняк. М.: ГЭОТАР-Медиа, 2006. 176 с. [Klinicheskie rekomendacii. Osteoartrit. Diagnostika i vedenie bol'nyh osteoartritom kolennyh i tazobedrennyh sustavov / pod red. O.M. Lesnyak. M.: GEHOTAR-Media, 2006. 176 s. (in Russian)].
16. Wang C.T., Lin J., Chang C.J. et al. Therapeutic effects of hyaluronic acid on osteoarthritis of the knee. A mtta-analisis of randomized controlled trials // J. Bone Joint Surg. Am. 2004. Vol. 86-a (3). P. 538–545.
17. Moore A.R., Willoughby D.A. Hyaluronan as a drag delivery system for diclofenac: a hypothesis for mode of action. Int J Tissue React. 1995. Vol. 17. P. 153–160.
18. Aichara S., Murakami N., Ishii R. еt al. Effects of sodium hyaluronate on the nociceptive response of rats with experimentally induced arthritis // Nippon Yakurigaku Zasshi. 1992. Vol. 100. P. 359–365.
19. Загородний Н.В., Ломтатидзе Е.Ш., Сергеев С.В., Карпович Н.И. Эндопротезирование крупных суставов человека. М., 2008. 65 c. [Zagorodnij N.V., Lomtatidze E.SH., Sergeev S.V., Karpovich N.I. EHndoprotezirovanie krupnyh sustavov cheloveka. M., 2008. 65 c. (in Russian)].
20. Прохоренко В.М., Бондарев Ю.Н. и др. Осложнения эндопротезирования тазобедренного сустава // Гнойные осложнения в травматологии и ортопедии: материалы науч.-практ. конф. СФО. Новосибирск, 2005. С. 8–9 [Prohorenko V.M., Bondarev Yu.N. i dr. Oslozhneniya ehndoprotezirovaniya tazobedrennogo sustava // Gnojnye oslozhneniya v travmatologii i ortopedii: materialy nauch.-prakt. konf. SFO. Novosibirsk, 2005. S. 8–9 (in Russian)].
21. Shimizu M., Higuchi H., Takagishi K. Clinical and biochemical characteristics after intra-articular injection for the treatment of osteoarthritis of the knee: prospective randomized study of sodium hyaluronate and corticosteroid // J.Orthop.Sci. 2010. Vol. 15 (1). P. 51–56.
22. Peng H., Zhou J.L., Liu S.Q. Hyaluronic acid inhibits nitric oxide-induced apoptosis and dedifferentiation of articular chondrocytes in vitro // Inflamm.Res. 2010. Vol. 59(7). P. 519–530.
23. Zhang F.J., Gao S.G., Cheng L. The effect of hyaluronic acid on osteopontin and CD44 mRNA of hibroblast-like synoviocytes in patients with osteoarthritis of the knee // Rheumatol.Int. 2013. Vol. 33(1). P. 79–83.
2. Ревматология: клинические рекомендации. М.: ГЭОТАР-Медиа, 2010. 752 с. [Revmatologiya: klinicheskie rekomendacii. M.: GEHOTAR-Media, 2010. 752 s. (in Russian)].
3. Ревматические заболевания в 3-х тт. Т. II. Заболевания костей и суставов: руководство / под ред. Д.Х. Клиппела и др. М.: ГЭОТАР-Медиа, 2014. 520 с. [Revmaticheskie zabolevaniya v 3 t. T. II. Zabolevaniya kostej i sustavov: rukovodstvo / pod red. D.H. Klippela i dr. M.: GEHOTAR-Media, 2014. 520 s. (in Russian)].
4. Hochberg M.C., Altman R.D. et al. ACR 2012 recommendations for the use of nonpharmacologic and pharmacologic therapies in osteoarthritis of the hand, hip and knee //Arthritis Care Res. 2012. Vol. 64 (4). P. 465–474.
5. Каратеев А.Е., Насонов Е.Л. и др. Рациональное применение НПВП в клинической практике. М.: ИМА-ПРЕСС, 2015. 36 с. [Karateev A.E., Nasonov E.L. i dr. Racional'noe primenenie NPVP v klinicheskoj praktike. M.: IMA-PRESS, 2015. 36 s. (in Russian)].
6. Balazs E.A. Viscosupplementation for treatment of osteoarthritis: from initial discovery to current status and resalts // Surg. Technol. Int. 2004. Vol. 12. P. 278–289.
7. Moreland L.W. Intra-articular hyaluronan (hyaluronic acid) and hylans for the treatment of osteoarthritis: mechanism of action // Arthritis Res. Ther. 2003. Vol. 5(2). P. 5–9.
8. Федорищев И.А. Гиалуроновая кислота. T. I. Тула: Изд-во ТулГУ, 2011. 238 c. [Fedorishchev I.A. Gialuronovaya kislota. T. I. Tula: Izd-vo TulGU, 2011. 238 s. (in Russian)].
9. Divire J.G., Zazulac B.T., Hevett T.E. Viscosupplementation for knee osteoarthritis: a systematic review // Clin Orthop Relot Res. 2007. Vol. 455. P. 113–122.
10. Balazs E.A., Denlinger J.I. Viscosupplementation: a neu concept in the treatment of osteoarthritis // J Rheumatol. 1993. Vol. 20(39). P. 3–9.
11. Takahashi K., Goomer R.S., Harwood F. et al. The effects of hyaluronan on matrix metalloproteinase-3 (MMP-3), interleukin-1 beta (IL-lbeta), and tissue inhibitor of metalloproteinase-1 (TINP-1) gene expression during the development of osteoarthritis // Osteoarthr Cartilage 1999. Vol. 7. P. 182–190.
12. Comer J.S., Kincaid S.A., Baird A.N. et al. Immunolocalization of stromelysin, tumor necrosis factor (TNF) alpha, and TNF receptors in atrophied canine articular cartilage treated with hyaluronic acid and transforming growth factor beta // Am J Vet Res. 1996. Vol. 57. P. 1488–1496.
13. Arrich J., Piribauer F., Mad P. et al. Intra-articular hyaluronic acid for the treatment on. osteoarthritis of the knee: systematic review and meta-analysis. CMAJ. 2005. Vol. 172. P. 1039–1043.
14. Bannuru R.R., Natov N.S., Dasi U.R. et al. Therapeutic trajectory following intra-articular hyaluronic acid injection in knee osteoarthritis-meta-analusis // Osteorthr Cartilage. 2011. Vol. 19. P. 611–619.
15. Клинические рекомендации. Остеоартрит. Диагностика и ведение больных остеоартритом коленных и тазобедренных суставов / под ред. О.М. Лесняк. М.: ГЭОТАР-Медиа, 2006. 176 с. [Klinicheskie rekomendacii. Osteoartrit. Diagnostika i vedenie bol'nyh osteoartritom kolennyh i tazobedrennyh sustavov / pod red. O.M. Lesnyak. M.: GEHOTAR-Media, 2006. 176 s. (in Russian)].
16. Wang C.T., Lin J., Chang C.J. et al. Therapeutic effects of hyaluronic acid on osteoarthritis of the knee. A mtta-analisis of randomized controlled trials // J. Bone Joint Surg. Am. 2004. Vol. 86-a (3). P. 538–545.
17. Moore A.R., Willoughby D.A. Hyaluronan as a drag delivery system for diclofenac: a hypothesis for mode of action. Int J Tissue React. 1995. Vol. 17. P. 153–160.
18. Aichara S., Murakami N., Ishii R. еt al. Effects of sodium hyaluronate on the nociceptive response of rats with experimentally induced arthritis // Nippon Yakurigaku Zasshi. 1992. Vol. 100. P. 359–365.
19. Загородний Н.В., Ломтатидзе Е.Ш., Сергеев С.В., Карпович Н.И. Эндопротезирование крупных суставов человека. М., 2008. 65 c. [Zagorodnij N.V., Lomtatidze E.SH., Sergeev S.V., Karpovich N.I. EHndoprotezirovanie krupnyh sustavov cheloveka. M., 2008. 65 c. (in Russian)].
20. Прохоренко В.М., Бондарев Ю.Н. и др. Осложнения эндопротезирования тазобедренного сустава // Гнойные осложнения в травматологии и ортопедии: материалы науч.-практ. конф. СФО. Новосибирск, 2005. С. 8–9 [Prohorenko V.M., Bondarev Yu.N. i dr. Oslozhneniya ehndoprotezirovaniya tazobedrennogo sustava // Gnojnye oslozhneniya v travmatologii i ortopedii: materialy nauch.-prakt. konf. SFO. Novosibirsk, 2005. S. 8–9 (in Russian)].
21. Shimizu M., Higuchi H., Takagishi K. Clinical and biochemical characteristics after intra-articular injection for the treatment of osteoarthritis of the knee: prospective randomized study of sodium hyaluronate and corticosteroid // J.Orthop.Sci. 2010. Vol. 15 (1). P. 51–56.
22. Peng H., Zhou J.L., Liu S.Q. Hyaluronic acid inhibits nitric oxide-induced apoptosis and dedifferentiation of articular chondrocytes in vitro // Inflamm.Res. 2010. Vol. 59(7). P. 519–530.
23. Zhang F.J., Gao S.G., Cheng L. The effect of hyaluronic acid on osteopontin and CD44 mRNA of hibroblast-like synoviocytes in patients with osteoarthritis of the knee // Rheumatol.Int. 2013. Vol. 33(1). P. 79–83.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
