Послеоперационная когнитивная дисфункция у детей (обзор литературы)
РМЖ. №9 от 05.09.2018 стр. 52-56
Рубрика:
Педиатрия
Общие анестетики представляют собой одно из величайших медицинских открытий, позволяющее проводить диагностические процедуры и хирургические вмешательства даже у самых маленьких пациентов, снижая неблагоприятные воздействия гемодинамических реакций в ответ на боль и стрессовую стимуляцию. Однако появляются данные о способности анестетиков оказывать нейротоксический эффект на головной мозг. Исследования на животных показали негативное влияние общих анестетиков на развивающийся мозг, проявляющееся в массивной апоптотической нейродегенерации, нарушении синаптогенеза и стойких нарушениях памяти и обучаемости. Клинические данные, свидетельствующие о развитии послеоперационной когнитивной дисфункции и нарушении в дальнейшем процесса обучения в детской популяции, остаются противоречивыми. Одной из главных целей исследований с участием детей является определение влияния наркоза на когнитивные функции в ранние и отсроченные периоды. В обзоре представлены патогенетические механизмы влияния общих анестетиков на развивающийся мозг, развития отсроченного когнитивного дефицита у детей, а также возможные варианты их медикаментозной профилактики.
Ключевые слова: послеоперационная когнитивная дисфункция, общая анестезия, детский возраст, нейропротекция, гопантеновая кислота, Пантогам.
Для цитирования: Пантелеева М.В., Овезов А.М., Котов А.С., Луговой А.В., Князев А.В. Послеоперационная когнитивная дисфункция у детей (обзор литературы). РМЖ. Медицинское обозрение. 2018;26(9):52-56.
Ключевые слова: послеоперационная когнитивная дисфункция, общая анестезия, детский возраст, нейропротекция, гопантеновая кислота, Пантогам.
Для цитирования: Пантелеева М.В., Овезов А.М., Котов А.С., Луговой А.В., Князев А.В. Послеоперационная когнитивная дисфункция у детей (обзор литературы). РМЖ. Медицинское обозрение. 2018;26(9):52-56.
Postoperative cognitive dysfunction in children (Literature review)
M.V. Panteleeva, A.M. Ovezov, A.S. Kotov, A.V. Lugovoy, A.V. Knyazev
Moscow Regional Research and Clinical Institute named after M.F. Vladimirskiy, Moscow
General anesthetics are one of the greatest medical discoveries, allowing to carry out diagnostic procedures and surgical interventions even in the very young patients, reducing the adverse effects of hemodynamic reactions in response to pain and stress stimulation. However, there are data on the ability of anesthetics to have a neurotoxic effect on the brain. Studies conducted on animals have shown a negative effect of general anesthetics on the developing brain, causing a widespread apoptotic neurodegeneration, impaired synaptogenesis and persistent memory and learning deficits. The clinical data, which testify to the development of postoperative cognitive dysfunction and the long-term learning disabilities in the pediatric population, remain conflicting. One of the main aims of the research in children is to determine the effect of anesthesia on cognitive function in early and delayed periods. The review presents data on the pathogenetic mechanisms of the effect of general anesthesia on the developing brain, occurring of delayed cognitive deficits in children, and possible approaches to their drug and non-drug prevention.
Key words: postoperative cognitive dysfunction, general anaesthesia, children, neuroprotection, hopantenic acid, Pantogam.
For citation: Panteleeva M.V., Ovezov A.M., Kotov A.S. et al. Postoperative cognitive dysfunction in children (Literature review) // RMJ. 2018. № 9. P. 52–56.
M.V. Panteleeva, A.M. Ovezov, A.S. Kotov, A.V. Lugovoy, A.V. Knyazev
Moscow Regional Research and Clinical Institute named after M.F. Vladimirskiy, Moscow
General anesthetics are one of the greatest medical discoveries, allowing to carry out diagnostic procedures and surgical interventions even in the very young patients, reducing the adverse effects of hemodynamic reactions in response to pain and stress stimulation. However, there are data on the ability of anesthetics to have a neurotoxic effect on the brain. Studies conducted on animals have shown a negative effect of general anesthetics on the developing brain, causing a widespread apoptotic neurodegeneration, impaired synaptogenesis and persistent memory and learning deficits. The clinical data, which testify to the development of postoperative cognitive dysfunction and the long-term learning disabilities in the pediatric population, remain conflicting. One of the main aims of the research in children is to determine the effect of anesthesia on cognitive function in early and delayed periods. The review presents data on the pathogenetic mechanisms of the effect of general anesthesia on the developing brain, occurring of delayed cognitive deficits in children, and possible approaches to their drug and non-drug prevention.
Key words: postoperative cognitive dysfunction, general anaesthesia, children, neuroprotection, hopantenic acid, Pantogam.
For citation: Panteleeva M.V., Ovezov A.M., Kotov A.S. et al. Postoperative cognitive dysfunction in children (Literature review) // RMJ. 2018. № 9. P. 52–56.
В обзоре представлены патогенетические механизмы влияния общих анестетиков на развивающийся мозг, развития отсроченного когнитивного дефицита у детей, а также возможные варианты их медикаментозной профилактики.
Проблема развития когнитивных нарушений в послеоперационном периоде у пациентов детского возраста в последнее время стала одной из наиболее актуальных в анестезиологии, детской неврологии и педиатрии. Общие анестетики представляют собой одно из величайших медицинских открытий, позволяющее проводить диагностические процедуры и хирургические вмешательства даже у самых маленьких пациентов, снижая неблагоприятные воздействия гемодинамических реакций в ответ на боль и стрессовую стимуляцию. Вместе с тем в последние десятилетия накоплен опыт способности анестетиков оказывать нейротоксический эффект на головной мозг [1].Синаптогенез
Развитие нервной системы — сложный и многоэтапный процесс, который начинается с образования большого количества нейробластов в нервной трубке. Избыток нейробластов (30–50%) подвергается запрограммированной клеточной гибели — апоптозу, который происходит в течение всей жизни, но наиболее активно — в период новорожденности. Оставшиеся в живых нейробласты мигрируют и образуют аксоны и дендриты. После появления электрической полярности с помощью кальциевых каналов начинается процесс синаптогенеза. Синаптогенез включает массивное дендритное ветвление и образование триллионов синаптических контактов между нейронами. Два основных нейротрансмиттера — глутамат и гамма-аминомасляная кислота (ГАМК) — контролируют все аспекты миграции нейронов, дифференцировку и синаптогенез. Синаптические контакты и образование стабильных рецепторных структур лежат в основе когнитивного и поведенческого развития. Центральная нервная система (ЦНС) человека при рождении сформирована неполностью и неравномерно. Спинной мозг и ствол мозга развиты относительно хорошо, в то время как лимбическая система и кора головного мозга остаются незрелыми. Масса мозга новорожденного, составляя приблизительно 335 г, удваивается к 6 мес. и утраивается к 12 мес. Именно этот период считается у человека периодом синаптогенеза [2–4].Экспериментальные исследования влияния анестетиков на развивающийся мозг
Еще в 1991 г. была опубликована работа [5], доказывающая негативный эффект длительного воздействия галотана (начиная с внутриутробного периода и далее в течение нескольких недель постнатального периода) на синаптогенез, миелинизацию нейронов и ряд нейрокогнитивных параметров у крыс.Дальнейшие исследования на животных также выявляли различные нейротоксические эффекты анестетиков на развивающийся мозг. Применение препаратов, блокирующих N-метил-D-аспартат-рецепторы (антагонистов NMDA-рецепторов) как подтип глутаматных рецепторов, приводило к развитию нейроапоптоза у 7-дневных детенышей крыс с последующим отсроченным изменением когнитивных и поведенческих функций [6–8]. Было отмечено негативное влияние комбинаций анестетиков (мидазолам, закись азота и изофлуран) на развивающийся головной мозг крыс в виде снижения уровня синаптических протеинов (синаптофизин, синаптобревин, амфифизин и др.), потери нейронов в ядрах таламуса, в гиппокампе и коре [9]. Эксперименты на мышах показали изменение нейрогуморальных функций после оперативных вмешательств в виде значительного повышения интерлейкинов-1β в гиппокампе и увеличения сывороточного белка S-100, роста уровня системных цитокинов, инициирующих процесс нейровоспаления [10, 11]. При изучении влияния закиси азота и изофлурана в дозах, достаточных для поддержания анестезии у 5–6-дневных детенышей макак, также было отмечено появление апоптоза и зон некротического повреждения нейронов в различных областях мозга в течение 8 часов [12, 13].
Таким образом, способность общих анестетиков вызывать апоптотическую нейродегенерацию с последующим отсроченным нарушением поведенческих и когнитивных функций была подтверждена рядом экспериментальных исследований на различных видах животных, включая приматов [13, 14–17]. Нейротоксичность общих анестетиков реализуется посредством множественных патогенетических механизмов и, как подтверждает ряд исследований, носит возрастозависимый и дозозависимый характер. Вероятность повреждения нейронов возрастает либо при повторных введениях анестетиков или их комбинаций, либо при продолжительности анестезии более 2–3-х часов [12, 18].
Этиопатогенез и предикторы послеоперационной когнитивной дисфункции
Несмотря на убедительные результаты экспериментальных и клинических исследований, подтверждающих нейротоксичность анестетиков, единой точки зрения на этиопатогенез послеоперационной когнитивной дисфункции (ПОКД) в настоящее время не существует. Многие исследователи сходятся во мнении, что патогенетические механизмы действия наркоза, которые лежат в основе формирования ПОКД, — это совокупность различных процессов без выделения какого-то одного ведущего механизма [19–21].Среди причин, приводящих к развитию ПОКД, ряд авторов отмечают генетическую предрасположенность, основанную на полиморфизме гена аполипопротеина Еε4. Другие исследователи считают наиболее вероятной причиной нарушение в системе ГАМК-эргических и холинергических связей в ЦНС либо непосредственную нейротоксичность самих анестетиков. Все большее значение придается возникновению периоперационной системной воспалительной реакции и интраоперационным факторам: длительной артериальной гипотензии с гипоперфузией мозга, наличию микроэмболии, приводящей к церебральной ишемии, эпизодам интранаркозного пробуждения [10, 15, 22, 23]. Разумеется, каждый из вышеперечисленных факторов может влиять на тяжесть когнитивных нарушений, однако свидетельств их ведущего участия в этиопатогенезе ПОКД с позиций доказательной медицины в настоящее время нет.
Однако уже хорошо известны предикторы развития ПОКД [24–26]:
отягощенный неврологический анамнез, исходные когнитивные нарушения;
возраст пациентов (пожилой, старческий, ранний детский);
мужской пол;
низкий образовательный ценз.
Таким образом, несмотря на множество проведенных исследований, единый механизм развития ПОКД не выявлен и считается, что развитие послеоперационных когнитивных нарушений носит многофакторный характер.
Влияние общих анестетиков на нейропсихологическое развитие детей различного возраста
Убедительные данные о нейротоксичности анестетиков и возникновение когнитивного дефицита, полученные в экспериментальных исследованиях на животных, в настоящее время не имеют четких подтверждений клиническими исследованиями в человеческой популяции.Проведение таких исследований имеет ряд ограничений:
отсутствует соответствующая контрольная группа, т. к. проведение оперативного вмешательства без анестезии и анестезии без показаний к хирургическому вмешательству или диагностической процедуре недопустимо с этической точки зрения;
не определен конечный результат оценки нейропсихологического развития в отдаленный период, т. к. уровень развития зависит от множества сопутствующих факторов;
дети и семьи могут отказаться от участия в исследовании либо могут быть утеряны для него по ряду причин;
трудно сопоставить сроки воздействия анестетиков на развивающийся мозг у животных и детей, определяя временной интервал формирования головного мозга, когда он максимально подвержен нейротоксическому влиянию анестетиков [18].
Одной из главных целей исследований, проводимых у детей, является определение влияния наркоза на когнитивные функции в ранние и отсроченные периоды.
Впервые сделали предположение о связи анестезии и долговременного когнитивного дефицита M.E. Backman и A.W. Kopf (1986) [28]. Отмечено, что, несмотря на относительно короткий период воздействия анестетиков (кетамина и галотана), у детей, прооперированных по поводу врожденных невусов, увеличилось число когнитивных нарушений и регрессивных поведенческих изменений, продолжающихся до 18 мес. после процедуры. Наиболее чувствительными к возникновению когнитивных расстройств были дети, получившие анестезию до 3-летнего возраста [28].
При обследовании R.T. Wilder et al. [29] 5320 детей, подвергшихся воздействию различных анестетиков при родах (пре- и интранатально), трудности в процессе обучения в возрасте до 19 лет были обнаружены у 921 ребенка,
однако достоверного отличия в группах детей с родоразрешением путем кесарева сечения и родоразрешением естественным путем (с применением регионарной анестезии) не отмечено. В дальнейшем в этой же когорте пациентов была исследована связь повторного воздействия анестезии в возрасте до 4-х лет и трудностей обучения. Выявлено, что у детей, получивших два и более анестезиологических пособия, трудности обучения встречались гораздо чаще. Кроме того, риск отсроченных нарушений познавательных функций увеличивался при длительности анестезиологического пособия более 2-х часов [30]. К сожалению, интерпретация этих результатов имеет некоторые ограничения и не может быть однозначно применена к современной анестезиологической практике [31, 32].
Для уменьшения влияния сопутствующих факторов на развитие когнитивного дефицита C.J. Kalkman et al.
провели ретроспективное когортное исследование 10 450 пар монозиготных близнецов, 306 из которых подвергались воздействию общей анестезии в возрасте до 3-х лет. Нарушения в процессе обучения были в равной степени выражены у обоих близнецов в паре, даже если один из них никогда не был оперирован под общим обезболиванием. В результате авторы пришли к предположению, что, вероятно, предикторами формирования когнитивного дефицита в позднем возрасте является не сочетание наркоза и операции, а сопутствующая патология и, возможно, многократное воздействие анестетиков [33].
Важные результаты получены в недавно завершившемся исследовании новорожденных, младенцев и детей младшего возраста, которым до 3-х лет проведены неотложные оперативные вмешательства по поводу заболеваний ЛОР-органов. Результаты данного исследования подчеркнули, что другие факторы играют бóльшую роль в возникновении длительного нейрокогнитивного дефицита, чем наркотическое воздействие собственно лекарственного средства. Однако этот вывод абсолютно не означает, что анестезия «безопасна» у маленьких детей, т. к. эти выводы относятся к проведению анестезии, а не к используемым обезболивающим препаратам. Кроме того, эти результаты не могут быть применены к более длительным и более сложным хирургическим процедурам [34–36].
При анализе исследований, проведенных до 2017 г., можно сделать один общий вывод: анестетики могут быть нейротоксичными. Однако в настоящее время еще остаются важные вопросы в изучении связи нейротоксичности анестетиков и долговременного когнитивного дефицита:
какие группы пациентов наиболее подвержены нейротоксическому действию анестезии?
увеличивается ли риск нейротоксичности при длительности и комбинации анестетиков?
существуют ли дозы анестетиков, ниже которых не проявляется нейротоксический эффект?
Решение данных вопросов — нелегкая задача, требующая согласованных действий ученых, медицинских работников и родителей маленьких пациентов [12].
В 2009 г. Американским управлением по контролю качества пищевых продуктов и лекарственных препаратов (FDA) совместно с Международным обществом анестезиологических исследований (IARS) разработана программа SmartTots, направленная на повышение безопасности применения анестезирующих препаратов путем устранения научных и клинических пробелов в отношении безопасности применяемых анестетиков. В настоящее время под эгидой этой программы выполняется два крупных проспективных исследования.
В 2012 г. начато многоцентровое рандомизированное контролируемое исследование GAS [40], целью которого является оценка различий эффектов регионарной и общей анестезии на нервно-психическое развитие у детей в гестационном возрасте до 60 нед. В рамках исследования 720 пациентов, оперированных по поводу паховой грыжи, распределены на 2 группы: с использованием общей анестезии на основе севофлурана (средняя длительность анестезии 54 мин) или регионарной спинальной анестезии. Оценка когнитивных функций должна проводиться в возрасте 2-х и 5 лет с использованием батареи тестов для различных возрастных групп. В настоящее время доступны двухлетние данные о результатах обследования 532 детей в практически равных соотношениях по обеим группам, которые не выявили неблагоприятного воздействия однократной кратковременной общей анестезии на когнитивные функции. Первичный результат исследования будет состоять в проверке интеллекта в возрасте 5 лет [37].
В другом крупном мультицентровом сиблинговом исследовании PANDAS (Pediatric Anesthesia Neuro Developmental Assessment Study) оценивалось нейропсихологическое развитие детей, подвергшихся оперативному вмешательству по поводу паховой грыжи в возрасте до 3-х лет, по сравнению с неоперированными близнецами. В исследование включено более 1000 «практически здоровых» детей, физический статус которых соответствует ASAI и ASAII. Средняя длительность общей анестезии составила 80 мин. Нейропсихологическое тестирование проведено в возрасте от 8 до 15 лет. Результаты исследования не выявили достоверных отличий в показателях нейропсихологического развития среди здоровых детей с однократным воздействием анестезии в возрасте до 3-х лет по сравнению с их неоперированными братьями и сестрами.
Одной из потенциальных причин отсутствия явного нейротоксического эффекта анестетиков в исследованиях GAS и PANDAS является время воздействия анестетика. Средняя экспозиция севофлурана составляла 54 и 84 мин соответственно. Исследования, проведенные на животных, также отмечают отсутствие неврологического дефицита при короткой длительности анестезии, а нейротоксичность анестетиков и последующие нейрокогнитивные нарушения отмечаются только после более длительных воздействий (более 2-х часов) [38, 39].
Несмотря на то, что полученные результаты этих крупных исследований являются обнадеживающими и предполагают, что краткосрочное однократное воздействие анестетика не влияет на долгосрочное когнитивное развитие ребенка, необходимость дальнейшего изучения нейротоксичности анестетиков и их влияния на когнитивный статус остается весьма актуальной [12, 40, 41].
Нейропротекция
Несмотря на появление в последние годы нового поколения эффективных и относительно безопасных анестетиков, проблема выбора варианта анестезиологического пособия и защита головного мозга с позиций снижения риска развития церебральных осложнений сохраняет свою актуальность, особенно у детей. Прежде всего, необходимо проводить первичную профилактику у пациентов с факторами риска, оптимизируя их интраоперационное ведение с использованием нефармакологической стратегии, которая включает гипотермию, поддержание стабильного уровня глюкозы в крови, гемоглобина, артериального давления, напряжения кислорода в мозговой ткани и уменьшение эмболической нагрузки [42].Термин «нейропротекция» относится к совокупности механизмов и стратегий, используемых для защиты нервной ткани от клеточных нарушений (таких как апоптоз, дегенерация, воспаление и энергетический сбой), связанных либо с хроническими нейродегенеративными процессами, либо с остро возникшими расстройствами.
В литературных источниках имеются данные не только о нейротоксичности, но и о нейропротективных свойствах ряда современных анестетиков. Севофлуран — галогенсодержащий ингаляционный анестетик, в экспериментах на животных показывает отчетливые церебральные защитные эффекты, значительно уменьшая кислород-глюкоза-индуцированную нейрональную клеточную гибель. В то же время анестезия севофлураном у детей вызывает послеоперационные поведенческие изменения, такие как увеличение частоты ажитации. Сопоставляя отрицательные и положительные свойства севофлурана, можно подчеркнуть, что при однократном непродолжительном воздействии он не вызывает апоптотической нейродегенерации в развивающемся мозге [43–46].
Пропофол — широко использующийся препарат для индукции и поддержания общей анестезии у взрослых и детей, является глобальным депрессантом ЦНС. В ряде работ отмечены нейропротективные эффекты пропофола, связанные с уменьшением церебрального метаболизма. С другой стороны, высокие концентрации пропофола увеличивают повреждение, вызванное недостатком кислорода и глюкозы у крыс. Поэтому пропофол, по мнению ряда авторов, не может быть расценен как клинически подтвержденный нейропротектор [44, 47–49].
В экспериментах на крысах обнаружено, что ксенон, который является антагонистом NMDA-рецепторов, не обладает апоптогенными свойствами, ограничивая индуцированный изофлураном апоптоз. Дексмедетомидин — агонист a2-адренергических рецепторов, уменьшает индуцированную изофлураном активацию каспазы-3 у 7-дневных крыс. У приматов совместное проведение литиевой инфузии защищало от индуцированного изофлураном апоптоза нейронов [16, 43, 50].
Данные о неоднозначности свойств анестетиков подтверждаются и тем, что число новых анестетиков, одобренных FDA за последние 30 лет (1985–2014), значительно меньше, чем за предыдущие 30 лет (1955–1984). Основная причина отсутствия разработок новых анестетиков может заключаться в том, что некоторые важные механизмы действия еще не обнаружены или что известные механизмы еще недостаточно исследованы. Таким образом, можно прогнозировать, что в ближайшем будущем долгосрочная безопасность анестетиков будет подвергнута серьезному сомнению [51]. Однако каждый из исследуемых анестетиков обладает как преимуществами, так и недостатками, поэтому выбор препарата зависит от особенностей конкретной ситуации.
Помимо определения возможных нейропротективных свойств различных групп анестетиков, в последние годы
были предприняты попытки найти новые или исследовать уже имеющиеся препараты, обладающие нейропротективными свойствами, для снижения нейротоксичности анестетиков и предотвращения послеоперационных осложнений. Например, в исследовании на старых особях крыс отмечено, что при применении прегабалина в течение 3-х или 7 дней после операции снижается дефицит памяти и уменьшается уровень провоспалительных цитокинов гиппокампа [52]. Есть данные о положительных эффектах применения пирацетама для уменьшения краткосрочного когнитивного дефицита у пациентов при операции аортокоронарного шунтирования [53]. В другом исследовании отмечены положительные свойства коэнзима Q10, который защищает клетки от потери энергии, что позволяет минимизировать последствия общей анестезии с использованием пропофола [54].
В рандомизированном открытом параллельном групповом клиническом исследовании, проведенном у 90 детей школьного возраста без сопутствующей соматической и неврологической патологии, показаны положительные свойства препарата гопантеновой кислоты, назначенной в дозе 40 мг/кг массы тела в сутки в течение месяца с первых суток после оперативного вмешательства (Пантогам сироп 100 мг/мл) для коррекции когнитивных нарушений в послеоперационном периоде оперативного вмешательства средней травматичности длительностью до 90 мин, выполненного в плановом порядке в условиях общего обезболивания с применением тотальной внутривенной анестезии на основе пропофола. Использование препарата гопантеновой кислоты (Пантогам сироп 100 мг/мл) для коррекции когнитивных послеоперационных изменений основано на возможности его проникновения через гематоэнцефалический барьер и воздействия на функциональную активность ЦНС, способствующую нормализации метаболизма ГАМК при различных видах патологии, улучшающую утилизацию глюкозы и кровоснабжение мозга, повышая устойчивость мозга к гипоксии и воздействию токсических веществ. Помимо нейрометаболических свойств, препарат обладает нейропротекторным и нейротрофическим действием, улучшая когнитивные функции и повышая психическую активность и объем познавательной деятельности. В результате проведенного исследования отмечено, что восстановление когнитивных функций до исходного предоперационного уровня по результатам нейропсихологического тестирования произошло уже на 7-е сутки, а в части случаев они значительно улучшились после месяца применения гопантеновой кислоты.
Через месяц после оперативного вмешательства ПОКД не зарегистрирована ни у одного пациента в группе детей, получавших церебропротекцию, в отличие от группы оперированных пациентов без последующей церебропротекции, где ПОКД выявлена в 92,3% случаев (рис. 1).
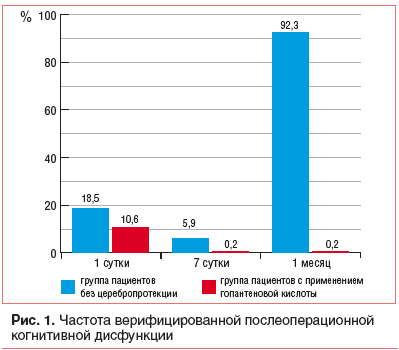
Помимо восстановления когнитивного потенциала при постоперационном применении Пантогама, отмечено также снижение до нормальных значений показателей по шкале Коннерса [55]. Таким образом, для медикаментозной коррекции развившихся когнитивных нарушений в послеоперационном периоде у детей школьного возраста возможно рекомендовать применение препарата гопантеновой кислоты (Пантогам) в дозе 40 мг/кг массы тела в сутки.
Заключение
Большинство исследований периоперационной фармакологической нейропротекции выполнены, как правило, во взрослой популяции. Поэтому на сегодняшний день мы вынуждены согласиться с мнением М. Weiss et al. [56], что, пока не найдено идеального анестетика либо нейропротектора, вместо того чтобы фокусироваться на нейротоксичности анестетиков, в первую очередь необходимо определить правильную тактику безопасного проведения анестезии у детей.Следовательно, остается крайне актуальной задача развития исследований по выявлению средств нейропротекции, используемых для профилактики периоперационных нарушений, прежде всего у детей, учитывая, что когнитивные нарушения в детском возрасте имеют высокую медико-
социальную значимость.
Литература
1. Hudson A.E., Hemmings H.C. Jr. Are anaesthetics toxic to the brain? // Br. J. Anaesth. 2011. Vol. 107 (1). P.30–37. doi: 10.1093/bja/aer122
2. Hansen T. G. Anesthesia-related neurotoxicity and the developing animal brain is not a significant problem in children // Pediatric Anesthesia. 2015. Vol. 25 (1). P.65–72. doi:10.1111/pan.12548
3. Jevtovic-Todorovic V. General Anesthetics and Neurotoxicity. How Much Do We Know? // Anesthesiology Clin. 2016. Vol. 34 (3). P.439–451. doi: 10.1016/j.anclin.2016.04.001
4. Sarnat H. B., Flores-Sarnat L. Developmental disorders of the nervous system // Neurology in Clinical Practice. 2008. P.1711–1737. doi:10.1016/b978–0–7506–7525–3.50102–3
5. Levin E. D., Uemura E., Bowman R. E. Neurobehavioral toxicology of halothane in rats // Neurotoxicol. Teratol. 1991. Vol. 13 (4). P.461–470. doi:10.1016/0892–0362(91) 90096-f.
6. Ikonomidou C., Bosch F., Miksa M. et al. Blockade of NMDA receptors and apoptotic neurodegeneration in the developing brain // Science. 1999. Vol. 283 (5398). P.70–74. doi: 10.1126/science.283.5398.70
7. Ji M. H., Wang Z. Y., Sun X. R. et al. Repeated Neonatal Sevoflurane Exposure-Induced Developmental Delays of Parvalbumin Interneurons and Cognitive Impairments Are Reversed by Environmental Enrichment // Molecular Neurobiology. 2016. Vol. 54 (5). P.628–637. doi: 10.1007/s12035–016–9943-x
8. Yonamine R., Satoh Y., Kodama M. et al. Coadministration of hydrogen gas as part of the carrier gas mixture suppresses neuronal apoptosis and subsequent behavioral deficits caused by neonatal exposure to sevoflurane in mice // Anesthesiology. 2013. Vol. 118 (1). P.105–113. doi:10.1097/aln.0b013e318275146d
9. Jevtovic-Todorovic V., Hartman R. E., Izumi Y. et al. Early exposure to common anesthetic agents causes widespread neurodegeneration in the developing ratbrain and persistent learning deficits // J. Neurosurgical Anesthesiology. 2003. Vol. 15 (3). P.295–296. doi:10.1097/00008506–200307000–00029
10. Cibelli M., Fidalgo A. R., Terrando N. et al. Role of interleukin-lbeta in postoperative cognitive dysfunction // Ann. Neurol. 2010. Vol. 68 (3). P.360–368. doi:10.1002/ana.22082
11. Zhenga B., Laia R., Lia J. Zuoa Z. Critical role of P2X7 receptors in the neuroinflammation and cognitive dysfunction after surgery // Brain, Behavior, and Immunity. 2017. Vol. 61. P.65–374. doi:10.1016/j.bbi.2017.01.005
12. Montana M., Evers A. S. Anesthetic Neurotoxicity: New Findings and Future Directions // The Journal of Pediatrics. 2017. Vol. 181. P.79–285. doi:10.1016/j.jpeds.2016.10.049
13. Zou X., Liu F, Zhang X. et al. Inhalation anesthetic-induced neuronal damage in the developing rhesus monkey // Neurotoxicol. Teratol. 2011. Vol. 33 (5). P.592–597. doi:10.1016/j.ntt.2011.06.003
14. Brambrink A. M., Evers A. S., Avidan M. S. et al. Isoflurane-induced Neuroapoptosis in the Neonatal Rhesus Macaque Brain // Anesthesiology. 2010. Vol. 112 (4). P.834–841. doi:10.1097/aln.0b013e3181d049cd
15. Fredriksson A., Ponten E., Gordh T., Eriksson P. Neonatal exposure to a combination of N-methyl-D-aspartate and gamma-aminobutyric acid type A receptor anesthetic agents potentiates apoptotic neurodegeneration and persistent behavioral deficits // Anesthesiology. 2007. Vol. 107. P.427–436. doi:10.1097/01.anes.0000278892.62305.9c
16. Noguchi K. K., Johnson S. A., Kristich L. E. et al. Lithium protects against anaesthesia neurotoxicity in the infant primate brain // Sci Rep. 2016. Vol. 6 (1). P.2427. doi:10.1038/srep22427
17. Slikker W., Zou X., Hotchkiss C. E. et al. Ketamine induced neuronal cell death in the perinatal rhesus monkey // Toxicol. Sci. 2007. Vol. 98 (1). P.45–58. doi:10.1093/toxsci/kfm084
18. Euliano Т. Effects of General Anesthesia During Pregnancy on the Child’s Ability to Learn // Anesthesiology Clin. 2013. Vol. 31 (3). P.95–607. doi:10.1016/j.anclin.2013.04.003
19. Billig N., Stockton P., Cohen-Mansfield J. Cognitive and affective changes after cataract surgery in an elderly population // Am. J. Geriatr Psychiatry. 1996. Vol. 4 (1). P.29–38. doi:10.1097/00019442–199624410–00004
20. Perouansky M., Pearce R. A., Hemmingset H. C. Inhaled anesthetics: Mechanisms of Action // Miller’s Anesthesia. 2010. Vol. 3. P.515–538.
21. Rasmussen L., Stygall J., Newman S. Cognitive dysfunction and other long-term complications of surgery and anesthesia. // Miller’s Anesthesia. 2010. Vol. (7). P.2805–2819. doi: doi.org/10.1016/b978–0–443–06959–8.00089–3
22. Gilberstadt H., Aberwald R., Crosbie S. et al. Effect of surgery on psychological and social functioning in elderly patients. Arch // Intern. Med. 1968. Vol. 122 (2). P.109–115. doi:10.1001/archinte.1968.00300070013003
23. Jackson W. M., Gray C. D., Jiang D. et al. Molecular Mechanisms of Anesthetic Neurotoxicity: A Review of the Current Literature // J. Neurosurg. Anesthesiol. 2016. Vol. 28 (4). P.361–372.doi:10.1097/ana.0000000000000348
24. Feinkohl I., Winterer G., Spies C. D., Pischon Tobias C. Cognitive Reserve and the Risk of Postoperative Cognitive Dysfunction // Dtsch. Arztebl. Int. 2017. Vol. 114. P.110–117. doi:10.3238/arztebl.2017.0110
25. Newman S., Stygall J., Hirani S. et al. Postoperative cognitive dysfunction after noncardiac surgery // Anesthesiology. 2007. Vol. 106 (3). P.572–590. doi:10.1097/00000542–200703000–00023
26. Sondekoppam R. V., Tsui B. C. Factors Associated With Risk of Neurologic Complications After Peripheral Nerve Blocks: A Systematic Review // Anesth. Analg. 2017. Vol. 124 (2). P.645–660. doi:10.1213/ane.0000000000001804
27. Block R. I., Thomas J. J., Bayman E. O. et al. A Users’ Guide to Interpreting Observational Studies of Pediatric Anesthetic Neurotoxicity. The Lessons of Sir Bradford Hill // Anesthesiology. 2012. Vol. 117 (3). P.494–503. doi:10.1097/aln.0b013e31826446a5
28. Backman M. E., Kopf A. W. Iatrogenic effects of general anesthesia in children: considerations in treating large congenital nevocytic nevi // J. Dermatol. Surg. Oncol. 1986. Vol. 12 (4). P.363–367. doi:10.1111/j.1524–4725.1986.tb01921.x
29. Wilder R. T., Flick R. P., Sprung J. et al. Early exposure to anesthesia and learning disabilities in a population-based birth cohort // Anesthesiology. 2009. Vol. 110 (4). P.796–804. doi:10.1097/01.anes.0000344728.34332.5d
30. Sprung J., Flick R. P., Katusic S. K. et al. Attention-deficit/hyperactivity disorder after early exposure to procedures requiring general anesthesia // Mayo Clin. Proc. 2012. Vol. 87 (2). P.120–129. doi:10.1016/j.mayocp.2011.11.008
31. Ing C., DiMaggio C., Whitehouse A. et al. Long-term differences in language and cognitive function after childhood exposure to anesthesia // Pediatrics. 2012. Vol. 130 (3). P.476–485. doi:10.1542/peds.2011–3822
32. Sun L. Early childhood general anaesthesia exposure and neurocognitive development. Br. J. Anaesth. 2011. Vol. 105 (Suppl 1). P.61–68. doi:10.1093/bja/aeq302
33. Kalkman C. J., Peelen L., Moons K. G. et al. Behavior and development in children andage at the time of first anesthetic exposure // Anesthesiology. 2009. Vol. 110 (4). P.805–812. doi:10.1097/aln.0b013e31819c7124
34. Di Maggio C. Sun L. S., Li G. Early childhood exposure to anesthesia and risk of developmental and behavioral disorders in a sibling birth cohort // Anesth. Analg. 2011. Vol. 113 (5). P.1143–1151. doi:10.1213/ane.0b013e3182147f42
35. Bartels M., Althoff R. R., Boomsma D. I. Anesthesia and cognitive performance in children: no evidence for a causal relationship // Twin Res. Hum. Genet. 2009. Vol. 12 (03). P.246–253. doi:10.1375/twin.12.3.246
36. Dokkedal U., Hansen T. G., Rasmussen L. S. et al. Cognitive Functioning after Surgery in Middle-aged and Elderly Danish Twins // Anesthesiology. 2016. Vol. 124 (2). P.312–332. doi:10.1097/aln.0000000000000957
37. Glatz P., Sandin R. H., Pedersen N. L. et al. Association of anesthesia and surgery during childhood with long-term academic performance // JAMA Pediatr. 2017. Vol. 171 (1). P.e163470. doi:10.1001/jamapediatrics.2016.3470
38. Weiss M., Hansen T. G., Engelhardt T. Ensuring safe anaesthesia for neonates, infants and young children: what really matters // Archives of Disease in Childhood. 2016. Vol. 101 (7). P.650–652. doi:10.1136/archdischild-2015–310104
39. Weiss M., Vutskits L., Hansen T. G., Engelhardt T. Safe Anesthesia For Every Tot: The Relevance of the SAFETOTS initiative // Curr. Opin Anaesthesiol. 2015. Vol. 28 (3). P.302–307. doi:10.1097/aco.0000000000000186
40. Davidson A. J., Disma N., de Graaff J. C. et al. Neurodevelopmental outcome at 2 years of age after general anaesthesia and awake-regional anaesthesia in infancy (GAS): an international multicentre, randomised controlled trial // Lancet. 2016. Vol. 387 (10015). P.239–250. doi:10.1016/s0140–6736 (15) 00608-x
41. Lei S. Y., Hache M., Loepke A. W. Clinical Research Into Anesthetic Neurotoxicity: Does Anesthesia Cause Neurological Abnormalities in Humans? // J. Neurosurg. Anesthesiol. 2014. Vol. 26 (4). P.349–357. doi:10.1097/ana.0000000000000117
42. Miller T. L., Park R., Sun L. S. Report on the Fifth PANDA Symposium on Anesthesia and Neurodevelopment in Children // J. Neurosurg. Anesthesiol. 2016. Vol. 28 (4). P.350–355. doi:10.1097/ana.0000000000000346
43. Slikker W., Zou X., Hotchkiss C. E. et al. Ketamine induced neuronal cell death in the perinatal rhesus monkey // Toxicol. Sci. 2007. Vol. 98 (1). P.45–58. doi:10.1093/toxsci/kfm084
44. Stratmann G., May L. D., Sall J. W. et al. Effect of hypercarbia and isoflurane on brain cell death and neurocognitive dysfunction in 7-day-old rats // Anesthesiology. 2009. Vol. 110 (4). P.849–861. doi:10.1097/aln.0b013e31819c7140
45. Abraham M. Protecting the anaesthetised brain // J Neuroanaesth Crit Care. 2014. Vol. 1 (1). P.20. doi:10.4103/2348–0548.124841
46. Ma D., Williamson P., Januszewski A. et al. Xenon mitigates isoflurane-induced neuronal apoptosis in the developing rodent brain // Anesthesiology. 2007. Vol. 106 (4). P.746–753. doi:10.1097/01.anes.0000264762.48920.80
47. Schifilliti D., Grasso G., Conti A., Fodale V. Anaesthetic-Related Neuroprotection Intravenous or Inhalational Agents? // CNS Drugs. 2010. Vol. 24 (11). P.893–907. doi:10.2165/11584760–000000000–00000
48. Wang Z. P., Zhang Z. H., Zeng Y. M. Protective effect of sevoflurane preconditioning on oxygen-glucose deprivation injury in rat hippocampal slices: the role of mitochondrial K (ATP) channels // Europ. J. Anaest. 2007. Vol. 24 (39). P.82. doi:10.1097/00003643–200706001–00301
49. Wise-Faberowski L., Raizada M. K., Sumners C. Desflurane and sevoflurane attenuate oxygen and glucose deprivation-induced neuronal cell death // J. Neurosurg. Anesthesiol. 2003. Vol. 15 (3). P.193–199. doi:10.1097/00008506–200307000–00006
50. Adombri C., Venturi L., Tani A. et al. Neuroprotective effects of propofol in models of cerebral ischemia: inhibition of mitochondrial swelling as a possible mechanism // Anesthesiology. 2006. Vol. 104 (1). P.80–89. doi:10.1097/00000542–200601000–00014
51. Grasshoff C., Gillessen T. Effects of propofol on N-methyl- D-aspartate receptor-mediated calcium increase in cultured rat cerebrocortical neurons // Eur. J. Anaesthesiol. 2005. Vol. 22 (6). P.467–470. doi:10.1017/s0265021505000803
52. Ito H., Watanabe Y., Isshiki A., Uchino H. Neuroprotective properties of propofol and midazolam, but not pentobarbital, on neuronal damage induced by forebrain ischemia, based on the GABAA receptors // Acta Anaesthesiol. Scand. 1999. Vol. 43 (2). P.153–162. doi:10.1034/j.1399–6576.1999.430206.x
53. Sanders R. D., Sun P., Patel S. et al. Dexmedetomidine provides cortical neuroprotection: impact on anaesthetic-induced neuroapoptosis in the rat developing brain // Acta Anaesthesiol. Scand. 2009. Vol. 54 (66). P.710–716. doi:10.1111/j.1399–6576.2009.02177.x
54. Vlassakov K. V., Kissin I. Decline in the Development of New Anesthetics. // Trends in Pharmacological Sciences. 2016. Vol. 37 (5). P.344–352. doi:10.1016/j.tips.2016.01.009
55. Kawano T., Eguchi S., Iwata H. et al. Pregabalin can prevent, but not treat, cognitive dysfunction following abdominal surgery in aged rats // Life Sciences. 2016. Vol. 148. P.211–219. doi:10.1016/j.lfs.2016.02.021
56. Fang Y., Qiu Z., Hu W. et al. Effect of piracetam on the cognitive performance of patients undergoing coronary bypass surgery: A meta analysis // Experimental and Therapeutic Medicine. 2014. Vol. 27. P.429–434. doi:10.3892/etm.2013.1425
57. B ergamini C., Moruzzi N., Volta F. et al. Role of mitochondrial complex I and protective effectof CoQ10 supplementation in propofol induced cytotoxicity // J. Bioenerg. Biomembr. 2016. Vol. 48 (4). P.413–423. doi:10.1007/s10863–016–9673–9
58. Пантелеева М. В., Овезов А. М., Котов А. С. и др. Применение препарата гопантеновой кислоты для коррекции когнитивных нарушений в послеоперационном периоде у детей // Вопросы практической педиатрии. 2017. Т. 5 (12). С.56–60 [Panteleyeva M.V., Ovezov A. M., Kotov A. S. i dr. Primeneniye preparata gopantenovoy kisloty dlya korrektsii kognitivnykh narusheniy v posleoperatsionnom periode u detey // Voprosy prakticheskoy pediatrii. 2017. T. 5 (12). S.56–60 (in Russian)]. doi: 10.20953\1817–7646–2017–5–56–60
59. Weiss M., Hansen T. G., Engelhardt T. Ensuring safe anaesthesia for neonates, infants and young children: what really matters // Arch. Dis. Child. 2016. Vol. 101 (7). P.650‒652. doi:10.1136/archdischild-2015—310104
2. Hansen T. G. Anesthesia-related neurotoxicity and the developing animal brain is not a significant problem in children // Pediatric Anesthesia. 2015. Vol. 25 (1). P.65–72. doi:10.1111/pan.12548
3. Jevtovic-Todorovic V. General Anesthetics and Neurotoxicity. How Much Do We Know? // Anesthesiology Clin. 2016. Vol. 34 (3). P.439–451. doi: 10.1016/j.anclin.2016.04.001
4. Sarnat H. B., Flores-Sarnat L. Developmental disorders of the nervous system // Neurology in Clinical Practice. 2008. P.1711–1737. doi:10.1016/b978–0–7506–7525–3.50102–3
5. Levin E. D., Uemura E., Bowman R. E. Neurobehavioral toxicology of halothane in rats // Neurotoxicol. Teratol. 1991. Vol. 13 (4). P.461–470. doi:10.1016/0892–0362(91) 90096-f.
6. Ikonomidou C., Bosch F., Miksa M. et al. Blockade of NMDA receptors and apoptotic neurodegeneration in the developing brain // Science. 1999. Vol. 283 (5398). P.70–74. doi: 10.1126/science.283.5398.70
7. Ji M. H., Wang Z. Y., Sun X. R. et al. Repeated Neonatal Sevoflurane Exposure-Induced Developmental Delays of Parvalbumin Interneurons and Cognitive Impairments Are Reversed by Environmental Enrichment // Molecular Neurobiology. 2016. Vol. 54 (5). P.628–637. doi: 10.1007/s12035–016–9943-x
8. Yonamine R., Satoh Y., Kodama M. et al. Coadministration of hydrogen gas as part of the carrier gas mixture suppresses neuronal apoptosis and subsequent behavioral deficits caused by neonatal exposure to sevoflurane in mice // Anesthesiology. 2013. Vol. 118 (1). P.105–113. doi:10.1097/aln.0b013e318275146d
9. Jevtovic-Todorovic V., Hartman R. E., Izumi Y. et al. Early exposure to common anesthetic agents causes widespread neurodegeneration in the developing ratbrain and persistent learning deficits // J. Neurosurgical Anesthesiology. 2003. Vol. 15 (3). P.295–296. doi:10.1097/00008506–200307000–00029
10. Cibelli M., Fidalgo A. R., Terrando N. et al. Role of interleukin-lbeta in postoperative cognitive dysfunction // Ann. Neurol. 2010. Vol. 68 (3). P.360–368. doi:10.1002/ana.22082
11. Zhenga B., Laia R., Lia J. Zuoa Z. Critical role of P2X7 receptors in the neuroinflammation and cognitive dysfunction after surgery // Brain, Behavior, and Immunity. 2017. Vol. 61. P.65–374. doi:10.1016/j.bbi.2017.01.005
12. Montana M., Evers A. S. Anesthetic Neurotoxicity: New Findings and Future Directions // The Journal of Pediatrics. 2017. Vol. 181. P.79–285. doi:10.1016/j.jpeds.2016.10.049
13. Zou X., Liu F, Zhang X. et al. Inhalation anesthetic-induced neuronal damage in the developing rhesus monkey // Neurotoxicol. Teratol. 2011. Vol. 33 (5). P.592–597. doi:10.1016/j.ntt.2011.06.003
14. Brambrink A. M., Evers A. S., Avidan M. S. et al. Isoflurane-induced Neuroapoptosis in the Neonatal Rhesus Macaque Brain // Anesthesiology. 2010. Vol. 112 (4). P.834–841. doi:10.1097/aln.0b013e3181d049cd
15. Fredriksson A., Ponten E., Gordh T., Eriksson P. Neonatal exposure to a combination of N-methyl-D-aspartate and gamma-aminobutyric acid type A receptor anesthetic agents potentiates apoptotic neurodegeneration and persistent behavioral deficits // Anesthesiology. 2007. Vol. 107. P.427–436. doi:10.1097/01.anes.0000278892.62305.9c
16. Noguchi K. K., Johnson S. A., Kristich L. E. et al. Lithium protects against anaesthesia neurotoxicity in the infant primate brain // Sci Rep. 2016. Vol. 6 (1). P.2427. doi:10.1038/srep22427
17. Slikker W., Zou X., Hotchkiss C. E. et al. Ketamine induced neuronal cell death in the perinatal rhesus monkey // Toxicol. Sci. 2007. Vol. 98 (1). P.45–58. doi:10.1093/toxsci/kfm084
18. Euliano Т. Effects of General Anesthesia During Pregnancy on the Child’s Ability to Learn // Anesthesiology Clin. 2013. Vol. 31 (3). P.95–607. doi:10.1016/j.anclin.2013.04.003
19. Billig N., Stockton P., Cohen-Mansfield J. Cognitive and affective changes after cataract surgery in an elderly population // Am. J. Geriatr Psychiatry. 1996. Vol. 4 (1). P.29–38. doi:10.1097/00019442–199624410–00004
20. Perouansky M., Pearce R. A., Hemmingset H. C. Inhaled anesthetics: Mechanisms of Action // Miller’s Anesthesia. 2010. Vol. 3. P.515–538.
21. Rasmussen L., Stygall J., Newman S. Cognitive dysfunction and other long-term complications of surgery and anesthesia. // Miller’s Anesthesia. 2010. Vol. (7). P.2805–2819. doi: doi.org/10.1016/b978–0–443–06959–8.00089–3
22. Gilberstadt H., Aberwald R., Crosbie S. et al. Effect of surgery on psychological and social functioning in elderly patients. Arch // Intern. Med. 1968. Vol. 122 (2). P.109–115. doi:10.1001/archinte.1968.00300070013003
23. Jackson W. M., Gray C. D., Jiang D. et al. Molecular Mechanisms of Anesthetic Neurotoxicity: A Review of the Current Literature // J. Neurosurg. Anesthesiol. 2016. Vol. 28 (4). P.361–372.doi:10.1097/ana.0000000000000348
24. Feinkohl I., Winterer G., Spies C. D., Pischon Tobias C. Cognitive Reserve and the Risk of Postoperative Cognitive Dysfunction // Dtsch. Arztebl. Int. 2017. Vol. 114. P.110–117. doi:10.3238/arztebl.2017.0110
25. Newman S., Stygall J., Hirani S. et al. Postoperative cognitive dysfunction after noncardiac surgery // Anesthesiology. 2007. Vol. 106 (3). P.572–590. doi:10.1097/00000542–200703000–00023
26. Sondekoppam R. V., Tsui B. C. Factors Associated With Risk of Neurologic Complications After Peripheral Nerve Blocks: A Systematic Review // Anesth. Analg. 2017. Vol. 124 (2). P.645–660. doi:10.1213/ane.0000000000001804
27. Block R. I., Thomas J. J., Bayman E. O. et al. A Users’ Guide to Interpreting Observational Studies of Pediatric Anesthetic Neurotoxicity. The Lessons of Sir Bradford Hill // Anesthesiology. 2012. Vol. 117 (3). P.494–503. doi:10.1097/aln.0b013e31826446a5
28. Backman M. E., Kopf A. W. Iatrogenic effects of general anesthesia in children: considerations in treating large congenital nevocytic nevi // J. Dermatol. Surg. Oncol. 1986. Vol. 12 (4). P.363–367. doi:10.1111/j.1524–4725.1986.tb01921.x
29. Wilder R. T., Flick R. P., Sprung J. et al. Early exposure to anesthesia and learning disabilities in a population-based birth cohort // Anesthesiology. 2009. Vol. 110 (4). P.796–804. doi:10.1097/01.anes.0000344728.34332.5d
30. Sprung J., Flick R. P., Katusic S. K. et al. Attention-deficit/hyperactivity disorder after early exposure to procedures requiring general anesthesia // Mayo Clin. Proc. 2012. Vol. 87 (2). P.120–129. doi:10.1016/j.mayocp.2011.11.008
31. Ing C., DiMaggio C., Whitehouse A. et al. Long-term differences in language and cognitive function after childhood exposure to anesthesia // Pediatrics. 2012. Vol. 130 (3). P.476–485. doi:10.1542/peds.2011–3822
32. Sun L. Early childhood general anaesthesia exposure and neurocognitive development. Br. J. Anaesth. 2011. Vol. 105 (Suppl 1). P.61–68. doi:10.1093/bja/aeq302
33. Kalkman C. J., Peelen L., Moons K. G. et al. Behavior and development in children andage at the time of first anesthetic exposure // Anesthesiology. 2009. Vol. 110 (4). P.805–812. doi:10.1097/aln.0b013e31819c7124
34. Di Maggio C. Sun L. S., Li G. Early childhood exposure to anesthesia and risk of developmental and behavioral disorders in a sibling birth cohort // Anesth. Analg. 2011. Vol. 113 (5). P.1143–1151. doi:10.1213/ane.0b013e3182147f42
35. Bartels M., Althoff R. R., Boomsma D. I. Anesthesia and cognitive performance in children: no evidence for a causal relationship // Twin Res. Hum. Genet. 2009. Vol. 12 (03). P.246–253. doi:10.1375/twin.12.3.246
36. Dokkedal U., Hansen T. G., Rasmussen L. S. et al. Cognitive Functioning after Surgery in Middle-aged and Elderly Danish Twins // Anesthesiology. 2016. Vol. 124 (2). P.312–332. doi:10.1097/aln.0000000000000957
37. Glatz P., Sandin R. H., Pedersen N. L. et al. Association of anesthesia and surgery during childhood with long-term academic performance // JAMA Pediatr. 2017. Vol. 171 (1). P.e163470. doi:10.1001/jamapediatrics.2016.3470
38. Weiss M., Hansen T. G., Engelhardt T. Ensuring safe anaesthesia for neonates, infants and young children: what really matters // Archives of Disease in Childhood. 2016. Vol. 101 (7). P.650–652. doi:10.1136/archdischild-2015–310104
39. Weiss M., Vutskits L., Hansen T. G., Engelhardt T. Safe Anesthesia For Every Tot: The Relevance of the SAFETOTS initiative // Curr. Opin Anaesthesiol. 2015. Vol. 28 (3). P.302–307. doi:10.1097/aco.0000000000000186
40. Davidson A. J., Disma N., de Graaff J. C. et al. Neurodevelopmental outcome at 2 years of age after general anaesthesia and awake-regional anaesthesia in infancy (GAS): an international multicentre, randomised controlled trial // Lancet. 2016. Vol. 387 (10015). P.239–250. doi:10.1016/s0140–6736 (15) 00608-x
41. Lei S. Y., Hache M., Loepke A. W. Clinical Research Into Anesthetic Neurotoxicity: Does Anesthesia Cause Neurological Abnormalities in Humans? // J. Neurosurg. Anesthesiol. 2014. Vol. 26 (4). P.349–357. doi:10.1097/ana.0000000000000117
42. Miller T. L., Park R., Sun L. S. Report on the Fifth PANDA Symposium on Anesthesia and Neurodevelopment in Children // J. Neurosurg. Anesthesiol. 2016. Vol. 28 (4). P.350–355. doi:10.1097/ana.0000000000000346
43. Slikker W., Zou X., Hotchkiss C. E. et al. Ketamine induced neuronal cell death in the perinatal rhesus monkey // Toxicol. Sci. 2007. Vol. 98 (1). P.45–58. doi:10.1093/toxsci/kfm084
44. Stratmann G., May L. D., Sall J. W. et al. Effect of hypercarbia and isoflurane on brain cell death and neurocognitive dysfunction in 7-day-old rats // Anesthesiology. 2009. Vol. 110 (4). P.849–861. doi:10.1097/aln.0b013e31819c7140
45. Abraham M. Protecting the anaesthetised brain // J Neuroanaesth Crit Care. 2014. Vol. 1 (1). P.20. doi:10.4103/2348–0548.124841
46. Ma D., Williamson P., Januszewski A. et al. Xenon mitigates isoflurane-induced neuronal apoptosis in the developing rodent brain // Anesthesiology. 2007. Vol. 106 (4). P.746–753. doi:10.1097/01.anes.0000264762.48920.80
47. Schifilliti D., Grasso G., Conti A., Fodale V. Anaesthetic-Related Neuroprotection Intravenous or Inhalational Agents? // CNS Drugs. 2010. Vol. 24 (11). P.893–907. doi:10.2165/11584760–000000000–00000
48. Wang Z. P., Zhang Z. H., Zeng Y. M. Protective effect of sevoflurane preconditioning on oxygen-glucose deprivation injury in rat hippocampal slices: the role of mitochondrial K (ATP) channels // Europ. J. Anaest. 2007. Vol. 24 (39). P.82. doi:10.1097/00003643–200706001–00301
49. Wise-Faberowski L., Raizada M. K., Sumners C. Desflurane and sevoflurane attenuate oxygen and glucose deprivation-induced neuronal cell death // J. Neurosurg. Anesthesiol. 2003. Vol. 15 (3). P.193–199. doi:10.1097/00008506–200307000–00006
50. Adombri C., Venturi L., Tani A. et al. Neuroprotective effects of propofol in models of cerebral ischemia: inhibition of mitochondrial swelling as a possible mechanism // Anesthesiology. 2006. Vol. 104 (1). P.80–89. doi:10.1097/00000542–200601000–00014
51. Grasshoff C., Gillessen T. Effects of propofol on N-methyl- D-aspartate receptor-mediated calcium increase in cultured rat cerebrocortical neurons // Eur. J. Anaesthesiol. 2005. Vol. 22 (6). P.467–470. doi:10.1017/s0265021505000803
52. Ito H., Watanabe Y., Isshiki A., Uchino H. Neuroprotective properties of propofol and midazolam, but not pentobarbital, on neuronal damage induced by forebrain ischemia, based on the GABAA receptors // Acta Anaesthesiol. Scand. 1999. Vol. 43 (2). P.153–162. doi:10.1034/j.1399–6576.1999.430206.x
53. Sanders R. D., Sun P., Patel S. et al. Dexmedetomidine provides cortical neuroprotection: impact on anaesthetic-induced neuroapoptosis in the rat developing brain // Acta Anaesthesiol. Scand. 2009. Vol. 54 (66). P.710–716. doi:10.1111/j.1399–6576.2009.02177.x
54. Vlassakov K. V., Kissin I. Decline in the Development of New Anesthetics. // Trends in Pharmacological Sciences. 2016. Vol. 37 (5). P.344–352. doi:10.1016/j.tips.2016.01.009
55. Kawano T., Eguchi S., Iwata H. et al. Pregabalin can prevent, but not treat, cognitive dysfunction following abdominal surgery in aged rats // Life Sciences. 2016. Vol. 148. P.211–219. doi:10.1016/j.lfs.2016.02.021
56. Fang Y., Qiu Z., Hu W. et al. Effect of piracetam on the cognitive performance of patients undergoing coronary bypass surgery: A meta analysis // Experimental and Therapeutic Medicine. 2014. Vol. 27. P.429–434. doi:10.3892/etm.2013.1425
57. B ergamini C., Moruzzi N., Volta F. et al. Role of mitochondrial complex I and protective effectof CoQ10 supplementation in propofol induced cytotoxicity // J. Bioenerg. Biomembr. 2016. Vol. 48 (4). P.413–423. doi:10.1007/s10863–016–9673–9
58. Пантелеева М. В., Овезов А. М., Котов А. С. и др. Применение препарата гопантеновой кислоты для коррекции когнитивных нарушений в послеоперационном периоде у детей // Вопросы практической педиатрии. 2017. Т. 5 (12). С.56–60 [Panteleyeva M.V., Ovezov A. M., Kotov A. S. i dr. Primeneniye preparata gopantenovoy kisloty dlya korrektsii kognitivnykh narusheniy v posleoperatsionnom periode u detey // Voprosy prakticheskoy pediatrii. 2017. T. 5 (12). S.56–60 (in Russian)]. doi: 10.20953\1817–7646–2017–5–56–60
59. Weiss M., Hansen T. G., Engelhardt T. Ensuring safe anaesthesia for neonates, infants and young children: what really matters // Arch. Dis. Child. 2016. Vol. 101 (7). P.650‒652. doi:10.1136/archdischild-2015—310104

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
