Кишечная микробиота и иммунитет: иммуномодулирующие эффекты Lactobacillus rhamnosus GG
РМЖ. №9 от 05.09.2018 стр. 39-44
Рубрика:
Педиатрия
Кишечная микробиота представляет собой совокупность огромного количества микроорганизмов, которые образуют своеобразный симбиоз с организмом человека, где каждый извлекает выгоды для своего существования и оказывает влияние на партнера. Можно уверенно говорить, что нет ни одной функции организма, на которую не влияла бы тем или иным способом кишечная микробиота.
Кишечник является самым большим иммунным органом человеческого организма, при этом эффективность функционирования местного иммунитета зависит от заселения кишечника индигенной микрофлорой. Особое место в процессе формирования и функционирования иммунной системы отводится лактобактериям.
В данном обзоре мы ставили перед собой цель донести наиболее полную информацию о составе и функциях микробиоты кишечника, ее роли в формировании иммунитета и терапевтических возможностях штамма Lactobacillus rhamnosus GG. Установленные механизмы молекулярного действия, детальная структурная и генетическая характеристика, данные рандомизированных исследований и метаанализов, а также огромный опыт эффективного практического использования LGG делают этот штамм средством выбора для профилактики и снижения тяжести целого ряда состояний, обусловленных дисфункцией иммунной системы.
Ключевые слова: микрофлора кишечника, иммунитет, пробиотик, Lactobacillus rhamnosus GG, LGG.
Для цитирования: Оганезова И.А. Кишечная микробиота и иммунитет: иммуномодулирующие эффекты Lactobacillus rhamnosus GG. РМЖ. Медицинское обозрение. 2018;26(9):39-44.
Кишечник является самым большим иммунным органом человеческого организма, при этом эффективность функционирования местного иммунитета зависит от заселения кишечника индигенной микрофлорой. Особое место в процессе формирования и функционирования иммунной системы отводится лактобактериям.
В данном обзоре мы ставили перед собой цель донести наиболее полную информацию о составе и функциях микробиоты кишечника, ее роли в формировании иммунитета и терапевтических возможностях штамма Lactobacillus rhamnosus GG. Установленные механизмы молекулярного действия, детальная структурная и генетическая характеристика, данные рандомизированных исследований и метаанализов, а также огромный опыт эффективного практического использования LGG делают этот штамм средством выбора для профилактики и снижения тяжести целого ряда состояний, обусловленных дисфункцией иммунной системы.
Ключевые слова: микрофлора кишечника, иммунитет, пробиотик, Lactobacillus rhamnosus GG, LGG.
Для цитирования: Оганезова И.А. Кишечная микробиота и иммунитет: иммуномодулирующие эффекты Lactobacillus rhamnosus GG. РМЖ. Медицинское обозрение. 2018;26(9):39-44.
Intestinal microbiota and immunity: immunomodulatory effects of Lactobacillus rhamnosus GG
I.A. Oganezova
North-Western State Medical University named after I. I. Mechnikov, St. Petersburg
Intestinal microbiota is a complex formed by a large number of microorganisms, which make a kind of symbiosis with the human body, where everyone gets benefits for his existence and influences the partner. It can be confidently said, that there are no such functions of the body, which are not effected by the intestinal microbiota in one way or another.
The intestine is the largest immune organ of the human body, while the effectiveness of local immunity depends on the colonization of the intestine by an indigenous microflora. Lactobacilli take a special place in the process of formation and functioning of the immune system.
The aim of this review was to provide the most complete information about the composition and functions of the intestinal microbiota, its role in the formation of immunity and the therapeutic possibilities of Lactobacillus rhamnosus GG. The established mechanisms of molecular action, the detailed structural and genetic characteristics, the data of randomized studies and meta-analyzes, and the great experience of effective practical use of LGG make this strain the means of choice for the prevention and relieving a number of conditions caused by immune system dysfunction.
Key words: intestinal microflora, immunity, probiotic, Lactobacillus rhamnosus GG, LGG.
For citation: Oganezova I.A. Intestinal microbiota and immunity: immunomodulatory effects of Lactobacillus rhamnosus GG //
RMJ. 2018. № 9. P. 39–44.
I.A. Oganezova
North-Western State Medical University named after I. I. Mechnikov, St. Petersburg
Intestinal microbiota is a complex formed by a large number of microorganisms, which make a kind of symbiosis with the human body, where everyone gets benefits for his existence and influences the partner. It can be confidently said, that there are no such functions of the body, which are not effected by the intestinal microbiota in one way or another.
The intestine is the largest immune organ of the human body, while the effectiveness of local immunity depends on the colonization of the intestine by an indigenous microflora. Lactobacilli take a special place in the process of formation and functioning of the immune system.
The aim of this review was to provide the most complete information about the composition and functions of the intestinal microbiota, its role in the formation of immunity and the therapeutic possibilities of Lactobacillus rhamnosus GG. The established mechanisms of molecular action, the detailed structural and genetic characteristics, the data of randomized studies and meta-analyzes, and the great experience of effective practical use of LGG make this strain the means of choice for the prevention and relieving a number of conditions caused by immune system dysfunction.
Key words: intestinal microflora, immunity, probiotic, Lactobacillus rhamnosus GG, LGG.
For citation: Oganezova I.A. Intestinal microbiota and immunity: immunomodulatory effects of Lactobacillus rhamnosus GG //
RMJ. 2018. № 9. P. 39–44.
В обзоре рассмотрена информация о составе и функциях микробиоты кишечника, ее роли в формировании иммунитета и терапевтических возможностях штамма Lactobacillus rhamnosus GG
Организм человека является одной из наиболее плотно населенных сред обитания на Земле. Число микроорганизмов, обитающих в такой «биологической системе», насчитывает порядка 100 трлн бактерий. Нормальная микрофлора — это качественное и количественное соотношение разнообразных микроорганизмов отдельных органов и систем, поддерживающее биохимическое, метаболическое и иммунное равновесие макроорганизма, необходимое для сохранения здоровья человека [1].Состав и функции кишечной микробиоты
Желудочно-кишечный тракт (ЖКТ) представляет собой самый обширный ареал обитания микрофлоры в организме. Применение современных молекулярно-генетических технологий позволило получить достаточно полные представления о числе, генетической неоднородности и сложности бактериальных компонентов микробиоты кишечника. Установлено, что микробиота кишечника человека является эволюционно сложившейся совокупностью микроорганизмов, существующей как сбалансированная микроэкологическая система, в которой симбионтная микрофлора находится в динамическом равновесии, формирует микробные ассоциации, занимающие в ней определенную экологическую нишу, и относится к важнейшим факторам, влияющим на здоровье человека [2].Значительная изменчивость состава микробиоты между людьми обнаруживается при рассмотрении таксономического уровня видов и штаммов внутри видов. Состав микробиоты каждого человека уникален. В этой экосистеме существуют все известные механизмы и типы взаимоотношений как между бактериями, так и между бактериями и клетками хозяина [3]. Данные некоторых молекулярно-филогенетических исследований свидетельствуют о наличии в человеческом кишечнике от 15 тыс. до 36 тыс. видов бактерий [4].
С позиций современной биологии человек вместе с живущими в его кишечнике генетически совместимыми микро-
организмами представляет собой единый «суперорганизм», обмен веществ которого обеспечивается четко организованной работой ферментов, кодируемых не только
геномом собственно человека, но и геномами всех симбиотических микроорганизмов. Следует подчеркнуть, что совокупность генов всех микроорганизмов человека — метагеном в 100–150 раз многочисленнее генома самого человека [5].
Нормальная микрофлора кишечника подразделяется на индигенную (облигатную) и факультативную (транзиторную). К индигенной относятся микроорганизмы, постоянно входящие в состав нормальной микрофлоры и играющие важную роль в метаболизме организма-хозяина и защите его от возбудителей инфекций. В здоровом кишечнике взрослого человека доминируют два бактериальных типа, на которые приходится более 90% бактериальных клеток: Firmicutes и Bacteroidetes. Микроорганизмы, относящиеся к нормальной микрофлоре кишечника, колонизируют как просвет ЖКТ, так и поверхность слизистой оболочки кишки (СОК), формируя при этом пристеночную (мукозную) и полостную микрофлору. Нормальная микрофлора кишечника на 92–95% состоит из строго анаэробных видов [6].
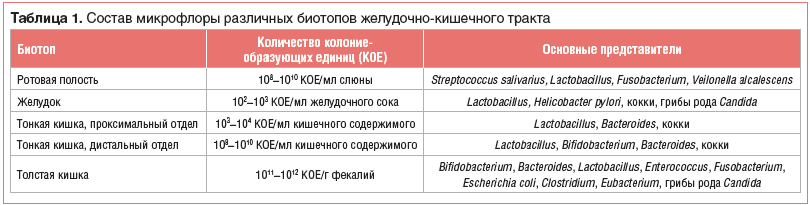
Основные представители микрофлоры, населяющие различные биотопы ЖКТ, представлены в таблице 1 [7].
Совокупность микроорганизмов и макроорганизм составляют своеобразный симбиоз, где каждый извлекает выгоды для своего существования и оказывает влияние на партнера. Функции кишечной микрофлоры по отношению к макроорганизму реализуются как локально, так и на системном уровне, при этом различные виды бактерий вносят свой вклад в это влияние. По своей роли в поддержании гомеостаза микробиота кишечника не уступает любому жизненно важному органу, поэтому любые нарушения ее состава могут приводить к значительным отклонениям в состоянии здоровья человека [8].
Основные функции кишечной микрофлоры и механизмы их реализации:
Защитная: обеспечение колонизационной резистентности: избирательное подавление факультативной флоры; препятствие адгезии, размножению и инвазии экзогенно поступающих микроорганизмов; продукция лизоцимов, бактериоцинов, Н2О2, антимикробных факторов.
Пищеварительная: продукция ферментов, обеспечивающих гидролиз и всасывание нутриентов.
Метаболическая: регуляция обмена желчных кислот, холестерина, водно-электролитного баланса, состава кишечных газов, поддержание дифференцированных значений рН, детоксикация экзогенных и эндогенных метаболитов.
Синтетическая: синтез витаминов В1, В2, В3, В5, В6, В9, В12, С, К, аминокислот, гормонов, биологически активных веществ, летучих жирных кислот.
Иммуномодулирующая: участие в созревании и функционировании иммунокомпетентных структур кишечника, синтез иммуноглобулинов, цитокинов.
Иммунная система кишечника
ЖКТ выполняет не только пищеварительную, но и иммунную функцию. Поскольку биоценоз кишечника является открытым, для поддержания относительного постоянства внутренней среды пищеварительный тракт должен обладать мощными механизмами антимикробной защиты. Регуляция иммунных реакций СОК является сложным процессом, который может изменяться в различных ситуациях: наличие или отсутствие повреждения слизистой оболочки, сохранение целостности и функциональности биопленки, наличие острых или хронических инфекций, зрелость иммунной системы, состояние питания, генетический потенциал индивидуума [9].Иммунная система кишечника является частью общей иммунной системы организма человека и в то же время отличается определенной автономностью. Главной ее задачей является обеспечение эффективного защитного барьера на границе соприкосновения внутренней среды макроорганизма и внешней среды, изобилующей огромным количеством живых и неживых антигенов — субстанций, несущих признаки чужеродной генетической информации [10].
Кишечник является самым большим иммунным органом человеческого организма: около 80% всех иммунокомпетентных клеток локализовано в СОК, около 25% СОК состоит из иммунологически активной ткани и клеток, каждый метр кишечника взрослого человека содержит около 1010 лимфоцитов. Морфологически иммунная система кишечника (GALT — gut associated lymphoid tissue) включает:
Клеточные элементы: интерэпителиальные лимфоциты, лимфоциты lamina propria, лимфоциты в фолликулах, плазматические клетки, макрофаги, тучные клетки, гранулоциты.
Структурные элементы: солитарные лимфоидные фолликулы, пейеровы бляшки, аппендикс, мезентериальные лимфатические узлы [11, 12].
Структурные элементы GALT-системы осуществляют адаптивный иммунный ответ, сущность которого состоит во взаимодействии между антиген-презентирующими клетками и Т-лимфоцитами, что контролируется клетками иммунологической памяти. После презентации антигенов Т-хелперам (Th) и макрофагам происходит трансформация Th0 клеток в Th1 или в Th2. Трансформация в Th1 сопровождается выработкой провоспалительных цитокинов: интерлейкинов (IL) 1, 2, 6, 8, 12, фактора некроза опухолей (tumor necrosis factor — TNF), активацией фагоцитоза, миграцией нейтрофилов, усилением окислительных реакций и синтезом IgA. Все эти реакции направлены на элиминацию антигена. Дифференцировка в Th2 способствует выработке противовоспалительных цитокинов: IL-4, IL-10, IL-13, IL-17, трансформирующего фактора роста (transforming growth factor — TGF). Данный механизм осуществляет контролируемое противостояние чужеродному для организма антигенному материалу и одновременное сосуществование с собственной микрофлорой [13, 14].
Таким образом, главными функциями GALT-системы являются распознавание и устранение антигенов или формирование иммунологической толерантности к ним. Формирование иммунологической толерантности является важнейшим условием существования ЖКТ как барьера на границе внешней и внутренней среды. Поскольку и пища, и нормальная кишечная микрофлора являются антигенами, они не должны восприниматься организмом как нечто враждебное и отторгаться им, не должны вызывать развитие воспалительного ответа [14].
Важным звеном в механизмах иммунной защиты являются Тоll-подобные рецепторы (Тоll-like-receptors — TLR): трансмембранные молекулы, связывающие экстра- и интрацеллюлярные структуры. TLR в ЖКТ обеспечивают толерантность к индигенной флоре, снижение вероятности аллергических реакций, доставку антигена антиген-презентирующим клеткам, повышение плотности межклеточных соединений, индукцию антимикробных пептидов [15].
Помимо этого, в ЖКТ взрослого человека обнаруживаются иммуноглобулины всех классов. В норме преобладающим среди классов иммуноглобулинов в кишечнике является секреторный IgА (sIgА), соотношение клеток, продуцирующих Ig А, М и G, составляет 20:3:1; sIgА, который синтезируется в форме димера, хорошо приспособлен к функционированию в кишечнике — он резистентен к воздействию протеолитических ферментов. В отличие от IgG, основного системного иммуноглобулина, sIgА не является спутником воспаления, наоборот, связывая антигены на поверхности слизистой оболочки, sIgА препятствует их проникновению во внутреннюю среду и предотвращает развитие воспаления [16].
Роль кишечной микрофлоры в иммунных реакциях
Эффективность работы GALT-системы зависит от заселения кишечника индигенной микрофлорой. Существует точка зрения, что для полного созревания кишечника, лимфоидная ткань которого является частью иммунной системы, необходимо воздействие не только и не столько антигенов пищи, сколько антигенов нормальной микрофлоры. Бактерии-комменсалы определяют дифференцировку Т-клеток в пейеровых бляшках, они играют огромную роль в формировании пищевой толерантности, воздействуя на баланс Тh1/Th2 лимфоцитов. В кишечнике бактерии являются важнейшей составной частью биопленки: гликокаликс — слизь — IgA — нормофлора. Биопленка покрывает СОК изнутри, занимает все выпуклости, образуемые энтероцитами, и защищает слизистую оболочку от дегидратации, физической и химической агрессии, а также от атак микроорганизмов, бактериальных токсинов, паразитов [17].Исследования на животных, выращенных в стерильных условиях (гнотобионтах), показало, что в их кишечнике определяется низкое количество пейеровых бляшек и более чем 10-кратное снижение количества В-лимфоцитов, продуцирующих IgА. Количество гранулоцитов у таких животных также снижено, а имеющиеся гранулоциты не способны к фагоцитозу, лимфоидные структуры организма остаются рудиментарными. После имплантации стерильным животным представителей нормальной кишечной флоры (лактобацилл, бифидобактерий, энтерококков) у них происходит развитие иммунных структур GALT. Эта экспериментальная модель отражает нормальные онтогенетические процессы параллельного становления биоценоза и иммунной системы кишечника [18, 19].
Иммунная система в свою очередь регулирует баланс биоценоза кишечника, т. е. механизмы саморегуляции нормофлоры контролируются местным иммунитетом кишечника. Процесс специфической адгезии условно-патогенных и болезнетворных микроорганизмов к слизистой оболочке ЖКТ может блокироваться среди прочих факторов присутствием IgA и лизоцимом, которые, в свою очередь, способствуют адгезии к рецепторам представителей бифидо- и лактофлоры. Подтверждением роли IgA в предотвращении колонизации слизистых оболочек посторонними микроорганизмами является тот факт, что 99% бактерий представителей нормофлоры не покрыты секреторными иммуноглобулинами. В основе этого явления лежит феномен иммунологической толерантности к нормофлоре. Снижение количества нормофлоры влечет за собой дефицит IgA, в результате чего повышается колонизация слизистых оболочек условно-патогенной флорой [20].
Таким образом, кишечная микробиота необходима для формирования иммунной системы кишечника хозяина и поддержания гомеостаза кишечника. Учитывая значительное взаимодействие между биоценозом кишечника и системой местного иммунитета, целесообразно считать дисбактериоз не только микробиологической, но и иммунологической проблемой, что должно отражаться в лечебной тактике [21].
Влияние пробиотических препаратов на иммунный статус
Доказанное влияние микробиоты кишечника на иммунную адаптацию и становление толерантности организма к факторам внешней среды позволило использовать микроорганизмы — симбионты человека для профилактики и лечения целого ряда заболеваний. В течение последних десятилетий одновременно с ростом знаний о роли и значении кишечной микробиоты значительно возрос интерес к пробиотикам. Термин «probiotic» обозначает организм, участвующий в симбиозе. По P. Фуллеру (1989), пробиотики (эубиотики) — это живые микроорганизмы, которые благоприятно влияют на здоровье человека, нормализуя его кишечную микробиоту [22].Выделяют основные механизмы положительных эффектов пробиотиков, которые осуществляются на разных уровнях воздействия:
Влияние в просвете кишечника: конкурентное ингибирование адгезии патогенов; антимикробная активность (продукция органических кислот, бактерицидных веществ, снижение рН кишечного содержимого); обеспечение колонизационной резистентности кишечника за счет конкурентного антагонизма с микробами условно-патогенного и патогенного спектра; участие в иммунной защите.
Влияние на эпителиальном уровне: повышение продукции муцина; повышение барьерной функции путем укрепления межклеточных соединений; повышение продукции sIgA, что создает неблагоприятную среду для патогенных микроорганизмов, усиливая барьерную функцию кишечника.
Влияние на иммунный ответ: увеличение синтеза противовоспалительных цитокинов (TGF-β, IL-13, IL-4, IL-10); стимуляция врожденного иммунитета; модулирование функций дендритных клеток и моноцитов, что повышает толерантность к поступающим аллергенам [23, 24].
Иммуномодулирующие эффекты LGG
Особое место в процессе формирования и функционирования иммунной системы отводится лактобактериям. Лактобактерии — род Lactobacillus, семейство Lactobacillaceae, отдел Firmicutes — это неспорообразующие грамположительные палочки, облигатные или факультативные анаэробы с высокой ферментативной активностью. Лактофлора заселяет организм новорожденного ребенка в раннем постнатальном периоде. Средой обитания лактобацилл являются различные отделы ЖКТ — от полости рта до толстой кишки. В процессе нормального метаболизма они способны образовывать молочную кислоту, перекись водорода, продуцировать лизоцим и другие вещества с бактерицидной активностью (реутерин, плантарицин, лактоцидин, лактолин). В желудке и тонкой кишке лактобациллы являются основным микробиологическим звеном формирования колонизационной резистентности. Для данного феномена существует термин «quorum sensing», обозначающий координированное коллективное поведение популяций микроорганизмов с целью оптимальной адаптации и взаимодействия/конкуренции с другими микробами в условиях конкретной экологической ниши [25].Одним из наиболее изученных и апробированных пробиотических штаммов является Lactobacillus rhamnosus ATCC 53103 (Lactobacillus rhamnosus GG или LGG), выделенный из кишечника здорового человека в 1983 г. и запатентованный в 1985 г. Sherwood Gorbach и Barry Goldin на основании нескольких критериев: высокая адгезия к эпителию СОК in vitro, высокая устойчивость к кислой среде желудка, высокая противомикробная активность против кишечных патогенов, способность продуцировать молочную кислоту. Установлено, что LGG продуцирует антимикробные факторы, которые подавляют активность таких микроорганизмов, как Clostridium spp., Pseudomonas spp., Salmonella spp., Escherichia coli, Staphylococcus и Streptococcus spp. Несмотря на то что LGG активно подавляет рост кишечных патогенов, в отношении других симбионтов/комменсалов этот штамм демонстрирует пацифизм, не конкурируя с ними и не вытесняя другие лактобациллы, а также положительно влияет на адгезию бифидобактерий [26, 27].
Рецептором для LGG на клеточной поверхности эпителиальных, макрофагальных и других клеток иммунной системы являются TLR 2-го типа, которые стимулируют сигнальный каскад через фактор транскрипции NF-kB, что ведет к экспрессии широкого спектра цитокинов. В эксперименте было показано, что даже термически обработанные LGG повышают продукцию иммунокомпетентными клетками IL-4 и IL-10, а также дозозависимо снижают продукцию TNF-α, индуцируемую микробными липополисахаридами. Установлено, что LGG подавляют экспрессию генов, кодирующих субъединицы опосредующего аллергию высокоаффинного рецептора IgE (allergy-related high-affinity IgE receptor — FCER1) и H4-рецептор гистамина на тучных клетках, выделенных из периферической крови человека. Перечисленные механизмы определяют противовоспалительный и противоаллергический эффекты рассматриваемых микроорганизмов [13, 16, 28].
Важнейшими эффекторными молекулами в реализации иммуномодулирующего действия LGG считаются липотейхоевые кислоты (ЛТК) их клеточной стенки. Известно, что ЛТК распознаются паттерн-распознающим гетеродимером TLR2-TLR6 с участием корецепторов CD14 и CD36 [15]. Структура ЛТК у LGG детально охарактеризована; установлены субъединицы, отвечающие за взаимодействие с рецепторами врожденного иммунитета. Большую роль в пробиотических эффектах LGG играют структурные особенности их фимбрий. Последние обеспечивают высокую способность этого штамма к адгезии к слизистой оболочке ЖКТ и образованию биопленок. Установлены конкретные молекулы фимбрий, отвечающие за адгезию (SpaC и MBF) и образование биопленок (MabA). Еще одной группой структурных компонентов LGG, высвобождающихся при деградации бактериальной клетки и обладающих иммуномодулирующим действием, являются неметилированные CpG-олигонуклеотиды. Они являются агонистами эндосомальных рецепторов TLR9 и стимулируют клеточный иммунный ответ, зависимый от Th1 [29, 30].
Не только структурные компоненты, но и продукты LGG, в частности секретируемые белки, обладают биологической активностью и определяют пробиотическое действие лактобацилл. Установлено, что два белка, выделенных из надосадочной жидкости культур LGG,– Msp1/p75 и Msp2/p40 блокируют апоптоз эпителиоцитов кишечника. Каждый из этих белков активирует сигнальный пептид Akt, ингибирует индуцированный цитокинами апоптоз клеток кишечного эпителия и уменьшает их TNF-индуцированное повреждение, стимулирует клеточный рост в культурах колоноцитов, защищает эпителиальный барьер кишечника от повреждающего действия перекиси водорода [31]. Обсуждается и опосредованная иммуномодулирующая активность Msp1/p75 и Msp2/p40, которая связана с тем, что под влиянием гидролазной активности этих молекул из бактериального пептидогликана высвобождаются его биологически активные субъединицы — мурамилдипептиды, являющиеся агонистами цитозольных рецепторов NOD2, дефект проведения сигналов через которые играет ключевую роль в патогенезе воспалительных заболеваний кишечника [32, 33].
Таким образом, иммуномодулирующие эффекты LGG объясняют эффективность их применения при ряде заболеваний воспалительного и аллергического характера.
Терапевтические возможности LGG
В литературе описан целый ряд положительных эффектов LGG в отношении организма человека и их роль в профилактике ряда состояний. Способность LGG при введении извне стойко персистировать в ЖКТ человека-потребителя, большое количество исследовательских работ и последующее широкое практическое внедрение достаточно быстро вывели этот штамм в лидеры по изученности биологических свойств и доказательствам клинической эффектности и безопасности, в первую очередь в педиатрической практике [34, 35].Исследования с применением штамма LGG свидетельствуют о том, что он является самым эффективным пробиотиком в долговременной профилактике развития атопического дерматита у детей. Эпидемиологические данные показывают, что у детей с аллергией выявляются бóльшие количества клостридий и меньшие количества бифидо- и лактобактерий [36]. M. Nermes et al., изучая взаимодействие LGG с кожной и кишечной микробиотой и гуморальный иммунитет у грудных детей с атопическим дерматитом, продемонстрировали, что через 1 мес. после начала применения смеси на основе глубокого гидролизата казеина с добавлением LGG происходит статистически значимое снижение числа секретирующих IgA- и IgM-клеток, что косвенно указывает на то, что LGG ускоряют процесс созревания иммунной системы, а также оказывают стимулирующее действие в отношении функции кишечного барьера. Особенно важным представляется феномен значимого увеличения числа B-лимфоцитов памяти у получавших LGG грудных детей [37].
Интересными представляются исследования, посвященные профилактике аллергических заболеваний у детей раннего возраста с помощью модификации кишечной микробиоты посредством приема пробиотиков в период беременности и лактации. Установлено, что прием беременными женщинами пробиотиков вплоть до родов может влиять на состав микрофлоры кишечника младенца и увеличение противовоспалительных и иммунных регулирующих факторов в грудном молоке и пуповинной крови [34]. В 2008 г. К. Wickens et al. опубликовали результаты исследования, проведенного с участием 474 беременных женщин. В течение 1 мес. до родов и затем 6 мес. на фоне лактации женщины получали Lactobacillus rhamnosus, Bifidobacterium animalis subsp lactis или плацебо; кроме того, препарат давали непосредственно детям с рождения до 2 лет. В группе пациентов, принимавших Lactobacillus rhamnosus, заболеваемость атопическим дерматитом снизилась на 50%, в то время как в группе детей, получавших бифидобактерии, снижения заболеваемости не отмечено. Таким образом, авторы исследования подчеркнули важность используемого штамма: прием не любого пробиотика демонстрирует эффективность [38].
Клиническая эффективность пробиотиков определяется их совокупным действием как на механизмы формирования иммунологической толерантности, так и на процессы воспаления в кишечнике и проницаемость кишечной стенки. Одним из объективных методов оценки эффективности использования препаратов на основе пробиотических штаммов может быть определение уровня кальпротектина в кале [33]. Также в литературе появляются свидетельства взаимосвязи показателя фекального кальпротектина с аллергическими проявлениями и возможности его использования в качестве маркера пищевой аллергии и пищевой непереносимости. В работе Н.Б. Мигачевой с соавт. было показано, что прием комплекса лиофилизированных молочнокислых бактерий LGG с фруктоолигосахаридами обеспечивает купирование симптомов функциональных расстройств пищеварения и профилактический эффект в отношении развития атопического дерматита, что сопровождается выявлением у них более низкого уровня фекального кальпротектина [39].
Сегодня не вызывает сомнений способность LGG предотвращать и облегчать течение различных видов диареи,
в т. ч. ассоциированных с ротавирусами и Clostridium difficile. В частности, в метаанализе Н. Szajewska et al. подтверждено, что LGG является единственным пробиотическим штаммом, снижающим риск развития ротавирусной диареи, тяжесть и продолжительность заболевания [40]. В более поздних работах автора было показано, что применение пробиотика LGG является эффективным способом профилактики антибиотик-ассоциированной диареи [41].
Таким образом, многочисленные исследования демонстрируют существенное положительное влияние LGG на организм человека, в первую очередь в профилактике и лечении инфекционных и профилактике аллергических заболеваний.
В России LGG представлен в нескольких препаратах и продуктах, в некоторых из них — в сочетании с другими пробиотическими штаммами. Эффективная комбинация LGG и фруктоолигосахаридов содержится в синбиотике Нормобакт L (Polpharma, Польша), разрешенном к применению у взрослых и детей в возрасте от 1 мес. Нормобакт L содержит изолированный штамм LGG в высокой концентрации 4×109 КОЕ. Также препарат содержит фруктоолигосахариды (800 мг) — разновидность пребиотиков, которые представляют собой особые ферментируемые волокна, не переваривающиеся в кишечнике. Фруктоолигосахариды стимулируют рост нормальной микрофлоры кишечника, способствуют улучшению переваривания и поглощения питательных веществ, являются источником питания для эпителиальных клеток толстой кишки. Нормобакт L рекомендуется в качестве биологически активной добавки к пище как источник пробиотических микроорганизмов при следующих состояниях: дисбактериозе, приеме антибиотиков, кишечных инфекциях, нарушениях стула (диарея, запор), пищевой аллергии, атопическом дерматите, смене рациона и режима питания [42].
Заключение
Накоплен значительный объем данных, подтверждающих критическую роль кишечной микрофлоры в патогенезе различных метаболических, иммунологических и неврологических заболеваний. В связи с этим все большее внимание привлекает возможность влияния на здоровье человека с помощью персонифицированных пищевых и терапевтических стратегий, направленных на модифицирование кишечной микробиоты, к которым относят использование пробиотиков и пребиотиков.Целесообразность использования живых симбионтов/
комменсалов для модуляции иммунных реакций человека не вызывает сомнений. Обращение многих разработчиков пробиотических продуктов и препаратов к лактобациллам вполне оправданно в силу неуклонно расширяющейся доказательной базы, касающейся их безопасности и иммунокорригирующего влияния на здоровье человека. Установленные механизмы молекулярного действия, детальная структурная и генетическая характеристика, данные рандомизированных исследований и метаанализов, а также огромный опыт эффективного практического использования LGG делают этот штамм средством выбора для профилактики и снижения тяжести целого ряда заболеваний человека, опосредованных или сопровождающихся иммунным дисбалансом. С учетом приведенных в настоящем обзоре фактов вполне логичным представляется то, что LGG применяют для укрепления здоровья детей и взрослых в десятках стран мира.
Литература
1. Harmsen H. J., Goffau M. C. The Human Gut Microbiota // Adv Exp Med Biol. 2016. Vol. 902. P. 95–108. doi: 10.1007/978-3-319-31248-4_7.
2. Lin L., Zhang J. Role of intestinal microbiota and metabolites on gut homeostasis and human diseases // BMC Immunology. 2017. Vol. 18. P. 2. doi: 10.1186/s12865-016-0187-3.
3. Кожевников А. А., Раскина К. В., Мартынова Е. Ю. и др. Кишечная микробиота: современные представления о видовом составе, функциях и методах исследования // РМЖ. 2017. № 17. C. 1244–1247 [Kozhevnikov A.A., Raskina K.V., Marty`nova E.Yu. i dr. Kishechnaya mikrobiota: sovremenny`e predstavleniya o vidovom sostave, funkciyax i metodax issledovaniya // RMZh. 2017. № 17. S. 1244–1247 (in Russian)].
4. Sender R., Fuchs S., Milo R. Revised Estimates for the Number of Human and Bacteria Cells in the Body // PLoS Biology. 2016. Vol. 14 (8). e1002533. doi: 10.1371/journal.pbio.1002533.
5. Qin J., Li R., Raes J. et al. A human gut microbial gene catalog established by metagenomic sequencing // Nature. 2010. Vol. 464 (7285). P. 59–65. doi: 10.1038/nature08821.
6. Чаплин А. В., Ребриков Д. В., Болдырева М. Н. Микробиом человека // Вестник РГМУ. 2017. № 2. С. 5–13 [Chaplin A.V., Rebrikov D. V., Boldy`reva M. N. Mikrobiom cheloveka // Vestnik RGMU. 2017. № 2. S. 5–13 (in Russian)].
7. Cresci G. A., Bawden E. The Gut Microbiome: What we do and don’t know // Nutrition in clinical practice: official publication of the American Society for Parenteral and Enteral Nutrition. 2015. Vol. 30 (6). P. 734–746. doi: 10.1177/0884533615609899.
8. Landman C., Quévrain E. Gut microbiota: Description, role and pathophysiologic implications // Rev Med Interne. 2016. Vol. 37 (6). P. 418–423. doi: 10.1016/j.revmed.2015.12.012.
9. Блат С. Ф., Хавкин А. И. Микробиоценоз кишечника и иммунитет // Рос. вестн. перинатол. и педиат. 2011. T. 1 (56). C. 66–72 [Blat S.F., Xavkin A. I. Mikrobiocenoz kishechnika i immunitet // Ros Vestn Perinatol Pediat 2011. T. 1 (56). S. 66–72 (in Russian)].
10. Donaldson D. S., Else K. J., Mabbott N. A. The Gut-Associated Lymphoid Tissues in the Small Intestine, Not the Large Intestine, Play a Major Role in Oral Prion Disease Pathogenesis // Journal of Virology. 2015. Vol. 89 (18). P. 9532–9547. doi: 10.1128/JVI.01544–15.
11. Nochi T., Denton P. W., Wahl A., Garcia J. V. Cryptopatches are essential for the development of human GALT // Cell reports. 2013. Vol. 3 (6). P. 1874–1884. doi: 10.1016/j.celrep.2013.05.037.
12. El Aidy S., Dinan T. G., Cryan J. F. Gut Microbiota: The Conductor in the Orchestra of Immune-Neuroendocrine Communication // Clin Ther. 2015. Vol. 37 (5). P. 954–967. doi: 10.1016/j.clinthera.2015.03.002.
13. Mu C., Yang Y., Zhu W. Crosstalk Between The Immune Receptors and Gut Microbiota // Curr Protein Pept Sci. 2015. Vol. 16 (7). P. 622–631.
14. Littman D. R., Pamer E. G. Role of the commensal microbiota in normal and pathogenic host immune responses // Cell Host Microbe. 2011. Vol. 10 (4). P. 311–323. doi: 10.1016/j.chom.2011.10.004.
15. Frosali S., Pagliari D., Gambassi G. et al. How the Intricate Interaction among Toll-Like Receptors, Microbiota, and Intestinal Immunity Can Influence Gastrointestinal Pathology // J Immunol Res. 2015. P. 489821. doi: 10.1155/2015/489821.
16. Maranduba C. M. da C., De Castro S. B.R., de Souza G. T. et al. Intestinal Microbiota as Modulators of the Immune System and Neuroimmune System: Impact on the Host Health and Homeostasis // J Immunol Res. 2015. P. 931574. doi: 10.1155/2015/931574.
17. Ivanov I. I., Honda K. Intestinal commensal microbes as immune modulators // Cell Host Microbe. 2012. Vol. 12 (4). P. 496–508. doi: 10.1016/j.chom.2012.09.009.
18. Macpherson A. J., McCoy K. D. Standardised animal models of host microbial mutualism // Mucosal Immunol. 2015. Vol. 8 (3). P. 476–486. doi: 10.1038/mi.2014.113.
19. Wang H., Gao K., Wen K. et al. Lactobacillus rhamnosus GG modulates innate signaling pathway and cytokine responses to rotavirus vaccine in intestinal mononuclear cells of gnotobiotic pigs transplanted with human gut microbiota // BMC Microbiology. 2016. Vol. 16. P. 109. doi: 10.1186/s12866–016–0727–2.
20. Palm N. W., de Zoete M. R., Flavell R. A. Immune-microbiota interactions in health and disease // Clinical immunology (Orlando, Fla). 2015. Vol. 159 (2). P. 122–127. doi: 10.1016/j.clim.2015.05.014.
21. Schippa S., Conte M. P. Dysbiotic Events in Gut Microbiota: Impact on Human Health // Nutrients. 2014. Vol. 6 (12). P. 5786–5805. doi: 10.3390/nu6125786.
22. Бельмер С. В. Кисломолочные бактерии в продуктах питания: теоретические основы и практическое значение (на примере Lactobacillus rhamnosus GG) // Вопросы современной педиатрии. 2011. Т. 3 (10). С. 80–85 [Bel`mer S. V. Kislomolochny`e bakterii v produktax pitaniya: teoreticheskie osnovy` i prakticheskoe znachenie (na primere Lactobacillus rhamnosus GG) // Voprosy` sovremennoj pediatrii. 2011.Т. 3 (10). S. 80–85 (in Russian)].
23. Min Y. W., Rhee P. L. The Role of Microbiota on the Gut Immunology // Clin Ther. 2015. Vol. 37 (5). P. 968–975. doi: 10.1016/j.clinthera.2015.03.009.
24. Gensollen T., Iyer S. S., Kasper D. L., Blumberg R. S. How colonization by microbiota in early life shapes the immune system // Science (New York, NY). 2016. Vol. 352 (6285). P. 539–544. doi: 10.1126/science.aad9378.
25. Калюжин О. В. Пробиотические штаммы лактобацилл как иммуномодуляторы: в фокусе — Lactobacillus rhamnosus GG // Медицинский совет. 2017. № 9. С. 108–115 [Kalyuzhin O. V. Probioticheskie shtammy` laktobacill kak immunomodulyatory`: v fokuse — Lactobacillus rhamnosus GG // Medicinskij sovet. 2017. № 9. S. 108–115 (in Russian)].
26. Суржик А. В. Влияние пробиотической культуры Lactobacillus rhamnosus GG на иммунный ответ организма // Вопросы современной педиатрии. 2009. T. 2 (8). C. 54–58 [Surzhik A. V. Vliyanie probioticheskoj kul`tury` Lactobacillus rhamnosus GG na immunny`j otvet organizma // Voprosy` sovremennoj pediatrii. 2009. T. 2 (8). S. 54–58 (in Russian)].
27. Yan F., Polk D. B. Lactobacillus rhamnosus GG: An Updated Strategy to Use Microbial Products to Promote Health. Functional food reviews (Print). 2012. Vol. 4 (2). P. 77–84.
28. Belkaid Y., Harrison O. J. Homeostatic immunity and the microbiota // Immunity. 2017. Vol. 46 (4). P. 562–576. doi: 10.1016/j.immuni.2017.04.008.
29. Hepworth M. R., Fung T. C., Masur S. H. et al. Group 3 innate lymphoid cells mediate intestinal selection of commensal bacteria-specific CD4+ T cells // Science (New York, NY). 2015. Vol. 348 (6238). P. 1031–1035. doi: 10.1126/science.aaa4812.
30. Hepworth M. R., Monticelli L. A., Fung T. C. et al. Innate lymphoid cells regulate CD4+ T cell responses to intestinal commensal bacteria // Nature. 2013. Vol. 498 (7452). P. 113–117. doi: 10.1038/nature12240.
31. Gury-BenAri M., Thaiss C. F., Serafini N. The Spectrum and Regulatory Landscape of Intestinal Innate Lymphoid Cells Are Shaped by the Microbiome // Cell. 2016. Vol. 166 (5). P. 1231–1246. doi: 10.1016/j.cell.2016.07.043. Epub 2016 Aug 18.
32. Segers M. E., Lebeer S. Towards a better understanding of Lactobacillus rhamnosus GG — host interactions // Microbial Cell Factories. 2014. Vol. 13 (Suppl 1). S7. doi: 10.1186/1475–2859–13-S1-S7.
33. Каштанова Д. А., Егшатян Л. В., Ткачева О. Н. Участие микробиоты кишечника человека в процессах хронического системного воспаления // Клин. микробиол. и антимикроб. химиотер. 2015. T. 4 (17). C. 310–317 [Kashtanova D.A., Egshatyan L. V., Tkacheva O. N. Uchastie mikrobioty` kishechnika cheloveka v processax xronicheskogo sistemnogo vospaleniya // Klin mikrobiol antimikrob ximioter. 2015. T. 4 (17). S. 310–317 (in Russian)].
34. Монахов К. Н., Домбровская Д. К., Назаренко Э. В. Применение пробиотиков с Lactobacillus rhamnosus GG в профилактике атопического дерматита у детей // Фарматека. 2017. № 1. C. 61–65 [Monaxov K.N., Dombrovskaya D. K., Nazarenko E`.V. Primenenie probiotikov s Lactobacillus rhamnosus GG v profilaktike atopicheskogo dermatita u detej // Farmateka. 2017. № 1. S. 61–65 (in Russian)].
35. Савицкая Е. В. Эффективность использования пробиотика Lactobacillus rhamnosus GG в комплексном лечении пищевой аллергии, протекающей на фоне патологии поджелудочной железы, у детей младшего возраста // Здоровье ребенка. 2016. T. 5 (73). C. 95–100 [Saviczkaya E.V. E`ffektivnost` ispol`zovaniya probiotika lactobacillus Rhamnosus GG v kompleksnom lechenii pishhevoj allergii, protekayushhej na fone patologii podzheludochnoj zhelezy`, u detej mladshego vozrasta // Zdorov`e rebenka. 2016. T. 5 (73). S. 95–100 (in Russian)]. doi: 10.22141/2224–0551.5.1.73.1.2016.78950.
36. Foolad N., Brezinski E. A., Chase E. P., Armstrong A. W. Effect of nutrient supplementation on atopic dermatitis in children: a systematic review of probiotics, prebiotics, formula, and fatty acids // JAMA Dermatol. 2013. Vol. 149 (3). P. 350–355.
37. Nermes M., Kantele J. M., Atosuo T. J. et al. Interaction of orally administered Lactobacillus rhamnosus GG with skin and gut microbiota and humoral immunity in infants with atopic dermatitis // Clin. Exp. Allergy. 2010. Vol. 41. P. 370–377.
38. Wickens K., Black P. N., Stanley T. V. et al. A differential effect of 2 probiotics in the prevention of eczema and atopy: a double-blind, randomized, placebo-controlled trial // J Allergy Clin Immunol. 2008. Vol. 122 (4). P. 788–794. doi: 10.1016/j.jaci.2008.07.011.
39. Мигачева Н. Б., Печкуров Д. В., Каганова Т. И., Сушкова Т. В. Влияние приема синбиотического комплекса, содержащего Lactobacillus rhamnosus GG и фруктоолигосахариды, на динамику уровня фекального кальпротектина у детей первого года жизни // Альманах клинической медицины. 2017. T. 1 (45). C. 33–39 [Migacheva N.B., Pechkurov D. V., Kaganova T. I., Sushkova T. V. Vliyanie priema sinbioticheskogo kompleksa, soderzhashhego Lactobacillus rhamnosus GG i fruktooligosaxaridy`, na dinamiku urovnya fekal`nogo kal`protektina u detej pervogo goda zhizni // Al`manax klinicheskoj mediciny`. 2017. T. 1 (45). S. 33–39 (in Russian)].
40. Szajewska H., Skorka A., Ruszczynski M. et al. Metaanalysis: Lactobacillus GG for treating acute diarrhea in children // Aliment. Pharmacol. Ther. 2007. Vol. 25 (8). P. 871–881. doi: 10.1111/j.1365–2036.2007.03282.x.
41. Szajewska H., Kolodziej M. Systematic review with meta-analysis: Lactobacillus rhamnosus GG in the prevention of antibiotic-associated diarrhoea in children and adults. Aliment Pharmacol Ther. 2015. Vol. 42 (10). P. 1149–1157. doi: 10.1111/apt.13404.
42. Нормобакт L (Normobact L). Инструкция по применению [Normobakt L (Normobact L). Instruktsiya po primeneniyu (in Russian)] [Электронный ресурс]. URL: www.vidal.ru/drugs/normobact-l (дата обращения: 19.07.2018).
2. Lin L., Zhang J. Role of intestinal microbiota and metabolites on gut homeostasis and human diseases // BMC Immunology. 2017. Vol. 18. P. 2. doi: 10.1186/s12865-016-0187-3.
3. Кожевников А. А., Раскина К. В., Мартынова Е. Ю. и др. Кишечная микробиота: современные представления о видовом составе, функциях и методах исследования // РМЖ. 2017. № 17. C. 1244–1247 [Kozhevnikov A.A., Raskina K.V., Marty`nova E.Yu. i dr. Kishechnaya mikrobiota: sovremenny`e predstavleniya o vidovom sostave, funkciyax i metodax issledovaniya // RMZh. 2017. № 17. S. 1244–1247 (in Russian)].
4. Sender R., Fuchs S., Milo R. Revised Estimates for the Number of Human and Bacteria Cells in the Body // PLoS Biology. 2016. Vol. 14 (8). e1002533. doi: 10.1371/journal.pbio.1002533.
5. Qin J., Li R., Raes J. et al. A human gut microbial gene catalog established by metagenomic sequencing // Nature. 2010. Vol. 464 (7285). P. 59–65. doi: 10.1038/nature08821.
6. Чаплин А. В., Ребриков Д. В., Болдырева М. Н. Микробиом человека // Вестник РГМУ. 2017. № 2. С. 5–13 [Chaplin A.V., Rebrikov D. V., Boldy`reva M. N. Mikrobiom cheloveka // Vestnik RGMU. 2017. № 2. S. 5–13 (in Russian)].
7. Cresci G. A., Bawden E. The Gut Microbiome: What we do and don’t know // Nutrition in clinical practice: official publication of the American Society for Parenteral and Enteral Nutrition. 2015. Vol. 30 (6). P. 734–746. doi: 10.1177/0884533615609899.
8. Landman C., Quévrain E. Gut microbiota: Description, role and pathophysiologic implications // Rev Med Interne. 2016. Vol. 37 (6). P. 418–423. doi: 10.1016/j.revmed.2015.12.012.
9. Блат С. Ф., Хавкин А. И. Микробиоценоз кишечника и иммунитет // Рос. вестн. перинатол. и педиат. 2011. T. 1 (56). C. 66–72 [Blat S.F., Xavkin A. I. Mikrobiocenoz kishechnika i immunitet // Ros Vestn Perinatol Pediat 2011. T. 1 (56). S. 66–72 (in Russian)].
10. Donaldson D. S., Else K. J., Mabbott N. A. The Gut-Associated Lymphoid Tissues in the Small Intestine, Not the Large Intestine, Play a Major Role in Oral Prion Disease Pathogenesis // Journal of Virology. 2015. Vol. 89 (18). P. 9532–9547. doi: 10.1128/JVI.01544–15.
11. Nochi T., Denton P. W., Wahl A., Garcia J. V. Cryptopatches are essential for the development of human GALT // Cell reports. 2013. Vol. 3 (6). P. 1874–1884. doi: 10.1016/j.celrep.2013.05.037.
12. El Aidy S., Dinan T. G., Cryan J. F. Gut Microbiota: The Conductor in the Orchestra of Immune-Neuroendocrine Communication // Clin Ther. 2015. Vol. 37 (5). P. 954–967. doi: 10.1016/j.clinthera.2015.03.002.
13. Mu C., Yang Y., Zhu W. Crosstalk Between The Immune Receptors and Gut Microbiota // Curr Protein Pept Sci. 2015. Vol. 16 (7). P. 622–631.
14. Littman D. R., Pamer E. G. Role of the commensal microbiota in normal and pathogenic host immune responses // Cell Host Microbe. 2011. Vol. 10 (4). P. 311–323. doi: 10.1016/j.chom.2011.10.004.
15. Frosali S., Pagliari D., Gambassi G. et al. How the Intricate Interaction among Toll-Like Receptors, Microbiota, and Intestinal Immunity Can Influence Gastrointestinal Pathology // J Immunol Res. 2015. P. 489821. doi: 10.1155/2015/489821.
16. Maranduba C. M. da C., De Castro S. B.R., de Souza G. T. et al. Intestinal Microbiota as Modulators of the Immune System and Neuroimmune System: Impact on the Host Health and Homeostasis // J Immunol Res. 2015. P. 931574. doi: 10.1155/2015/931574.
17. Ivanov I. I., Honda K. Intestinal commensal microbes as immune modulators // Cell Host Microbe. 2012. Vol. 12 (4). P. 496–508. doi: 10.1016/j.chom.2012.09.009.
18. Macpherson A. J., McCoy K. D. Standardised animal models of host microbial mutualism // Mucosal Immunol. 2015. Vol. 8 (3). P. 476–486. doi: 10.1038/mi.2014.113.
19. Wang H., Gao K., Wen K. et al. Lactobacillus rhamnosus GG modulates innate signaling pathway and cytokine responses to rotavirus vaccine in intestinal mononuclear cells of gnotobiotic pigs transplanted with human gut microbiota // BMC Microbiology. 2016. Vol. 16. P. 109. doi: 10.1186/s12866–016–0727–2.
20. Palm N. W., de Zoete M. R., Flavell R. A. Immune-microbiota interactions in health and disease // Clinical immunology (Orlando, Fla). 2015. Vol. 159 (2). P. 122–127. doi: 10.1016/j.clim.2015.05.014.
21. Schippa S., Conte M. P. Dysbiotic Events in Gut Microbiota: Impact on Human Health // Nutrients. 2014. Vol. 6 (12). P. 5786–5805. doi: 10.3390/nu6125786.
22. Бельмер С. В. Кисломолочные бактерии в продуктах питания: теоретические основы и практическое значение (на примере Lactobacillus rhamnosus GG) // Вопросы современной педиатрии. 2011. Т. 3 (10). С. 80–85 [Bel`mer S. V. Kislomolochny`e bakterii v produktax pitaniya: teoreticheskie osnovy` i prakticheskoe znachenie (na primere Lactobacillus rhamnosus GG) // Voprosy` sovremennoj pediatrii. 2011.Т. 3 (10). S. 80–85 (in Russian)].
23. Min Y. W., Rhee P. L. The Role of Microbiota on the Gut Immunology // Clin Ther. 2015. Vol. 37 (5). P. 968–975. doi: 10.1016/j.clinthera.2015.03.009.
24. Gensollen T., Iyer S. S., Kasper D. L., Blumberg R. S. How colonization by microbiota in early life shapes the immune system // Science (New York, NY). 2016. Vol. 352 (6285). P. 539–544. doi: 10.1126/science.aad9378.
25. Калюжин О. В. Пробиотические штаммы лактобацилл как иммуномодуляторы: в фокусе — Lactobacillus rhamnosus GG // Медицинский совет. 2017. № 9. С. 108–115 [Kalyuzhin O. V. Probioticheskie shtammy` laktobacill kak immunomodulyatory`: v fokuse — Lactobacillus rhamnosus GG // Medicinskij sovet. 2017. № 9. S. 108–115 (in Russian)].
26. Суржик А. В. Влияние пробиотической культуры Lactobacillus rhamnosus GG на иммунный ответ организма // Вопросы современной педиатрии. 2009. T. 2 (8). C. 54–58 [Surzhik A. V. Vliyanie probioticheskoj kul`tury` Lactobacillus rhamnosus GG na immunny`j otvet organizma // Voprosy` sovremennoj pediatrii. 2009. T. 2 (8). S. 54–58 (in Russian)].
27. Yan F., Polk D. B. Lactobacillus rhamnosus GG: An Updated Strategy to Use Microbial Products to Promote Health. Functional food reviews (Print). 2012. Vol. 4 (2). P. 77–84.
28. Belkaid Y., Harrison O. J. Homeostatic immunity and the microbiota // Immunity. 2017. Vol. 46 (4). P. 562–576. doi: 10.1016/j.immuni.2017.04.008.
29. Hepworth M. R., Fung T. C., Masur S. H. et al. Group 3 innate lymphoid cells mediate intestinal selection of commensal bacteria-specific CD4+ T cells // Science (New York, NY). 2015. Vol. 348 (6238). P. 1031–1035. doi: 10.1126/science.aaa4812.
30. Hepworth M. R., Monticelli L. A., Fung T. C. et al. Innate lymphoid cells regulate CD4+ T cell responses to intestinal commensal bacteria // Nature. 2013. Vol. 498 (7452). P. 113–117. doi: 10.1038/nature12240.
31. Gury-BenAri M., Thaiss C. F., Serafini N. The Spectrum and Regulatory Landscape of Intestinal Innate Lymphoid Cells Are Shaped by the Microbiome // Cell. 2016. Vol. 166 (5). P. 1231–1246. doi: 10.1016/j.cell.2016.07.043. Epub 2016 Aug 18.
32. Segers M. E., Lebeer S. Towards a better understanding of Lactobacillus rhamnosus GG — host interactions // Microbial Cell Factories. 2014. Vol. 13 (Suppl 1). S7. doi: 10.1186/1475–2859–13-S1-S7.
33. Каштанова Д. А., Егшатян Л. В., Ткачева О. Н. Участие микробиоты кишечника человека в процессах хронического системного воспаления // Клин. микробиол. и антимикроб. химиотер. 2015. T. 4 (17). C. 310–317 [Kashtanova D.A., Egshatyan L. V., Tkacheva O. N. Uchastie mikrobioty` kishechnika cheloveka v processax xronicheskogo sistemnogo vospaleniya // Klin mikrobiol antimikrob ximioter. 2015. T. 4 (17). S. 310–317 (in Russian)].
34. Монахов К. Н., Домбровская Д. К., Назаренко Э. В. Применение пробиотиков с Lactobacillus rhamnosus GG в профилактике атопического дерматита у детей // Фарматека. 2017. № 1. C. 61–65 [Monaxov K.N., Dombrovskaya D. K., Nazarenko E`.V. Primenenie probiotikov s Lactobacillus rhamnosus GG v profilaktike atopicheskogo dermatita u detej // Farmateka. 2017. № 1. S. 61–65 (in Russian)].
35. Савицкая Е. В. Эффективность использования пробиотика Lactobacillus rhamnosus GG в комплексном лечении пищевой аллергии, протекающей на фоне патологии поджелудочной железы, у детей младшего возраста // Здоровье ребенка. 2016. T. 5 (73). C. 95–100 [Saviczkaya E.V. E`ffektivnost` ispol`zovaniya probiotika lactobacillus Rhamnosus GG v kompleksnom lechenii pishhevoj allergii, protekayushhej na fone patologii podzheludochnoj zhelezy`, u detej mladshego vozrasta // Zdorov`e rebenka. 2016. T. 5 (73). S. 95–100 (in Russian)]. doi: 10.22141/2224–0551.5.1.73.1.2016.78950.
36. Foolad N., Brezinski E. A., Chase E. P., Armstrong A. W. Effect of nutrient supplementation on atopic dermatitis in children: a systematic review of probiotics, prebiotics, formula, and fatty acids // JAMA Dermatol. 2013. Vol. 149 (3). P. 350–355.
37. Nermes M., Kantele J. M., Atosuo T. J. et al. Interaction of orally administered Lactobacillus rhamnosus GG with skin and gut microbiota and humoral immunity in infants with atopic dermatitis // Clin. Exp. Allergy. 2010. Vol. 41. P. 370–377.
38. Wickens K., Black P. N., Stanley T. V. et al. A differential effect of 2 probiotics in the prevention of eczema and atopy: a double-blind, randomized, placebo-controlled trial // J Allergy Clin Immunol. 2008. Vol. 122 (4). P. 788–794. doi: 10.1016/j.jaci.2008.07.011.
39. Мигачева Н. Б., Печкуров Д. В., Каганова Т. И., Сушкова Т. В. Влияние приема синбиотического комплекса, содержащего Lactobacillus rhamnosus GG и фруктоолигосахариды, на динамику уровня фекального кальпротектина у детей первого года жизни // Альманах клинической медицины. 2017. T. 1 (45). C. 33–39 [Migacheva N.B., Pechkurov D. V., Kaganova T. I., Sushkova T. V. Vliyanie priema sinbioticheskogo kompleksa, soderzhashhego Lactobacillus rhamnosus GG i fruktooligosaxaridy`, na dinamiku urovnya fekal`nogo kal`protektina u detej pervogo goda zhizni // Al`manax klinicheskoj mediciny`. 2017. T. 1 (45). S. 33–39 (in Russian)].
40. Szajewska H., Skorka A., Ruszczynski M. et al. Metaanalysis: Lactobacillus GG for treating acute diarrhea in children // Aliment. Pharmacol. Ther. 2007. Vol. 25 (8). P. 871–881. doi: 10.1111/j.1365–2036.2007.03282.x.
41. Szajewska H., Kolodziej M. Systematic review with meta-analysis: Lactobacillus rhamnosus GG in the prevention of antibiotic-associated diarrhoea in children and adults. Aliment Pharmacol Ther. 2015. Vol. 42 (10). P. 1149–1157. doi: 10.1111/apt.13404.
42. Нормобакт L (Normobact L). Инструкция по применению [Normobakt L (Normobact L). Instruktsiya po primeneniyu (in Russian)] [Электронный ресурс]. URL: www.vidal.ru/drugs/normobact-l (дата обращения: 19.07.2018).

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
