Компьютерная навигация в хирургии хронического гнойного среднего отита
РМЖ. №3 (II) от 02.04.2018 стр. 43-47
Рубрика:
Оториноларингология
Практически любая форма хронического гнойного среднего отита (ХГСО) подлежит хирургическому лечению.
Цель исследования: определить преимущества использования компьютерной навигации в хирургическом лечении пациентов с ХГСО.
Материал и методы: в условиях отделения оториноларингологии Клинического медицинского центра МГМСУ им. А. И. Евдокимова за 2015–2017 гг. пролечено 25 пациентов с ХГСО с применением компьютерной навигации. Всем пациентам было проведено хирургическое лечение открытым вариантом санирующих операций на среднем ухе с тимпанопластикой или без таковой в зависимости от распространенности процесса.
Результаты исследования: во всех случаях навигация способствовала хирургии, отображая остаточные пораженные воздушные ячейки. Особенно полезна была при работе с полостями ранее оперированных сосцевидных отростков. Во время операций система заверила полное вскрытие пораженных патологическим процессом клеток сосцевидного отростка, включая тегментальные и синодуральные клетки. Кроме того, система позволила, обнаружив фистулы лабиринта и обнаженной твердой мозговой оболочки, одномоментно выполнить пластику дефекта, избегая при этом повреждения окружающих структур. Каких-либо серьезных осложнений во время операций не наблюдалось.
Выводы: по нашему мнению, наибольшими преимуществами использования компьютерной навигации в хирургии ХГСО являются: более тщательное удаление патологического содержимого, бóльшая безопасность во время сложных манипуляций (особенно при измененной нормальной анатомии среднего уха), снижение количества осложнений за счет избегания травм нейроваскулярных структур, снижение кровопотери, продолжительности пребывания в стационаре, количества рецидивов и повторных операций и соответственно снижение затрат на лечение, а также улучшение функциональных результатов.
Ключевые слова: хронический гнойный средний отит, ХГСО, компьютерная навигация, навигационная поддержка, эпитимпанит, эпимезотимпанит, тимпанопластика.
Для цитирования: Овчинников А.Ю., Хон Е.М., Щербаков А.Ю. Компьютерная навигация в хирургии хронического гнойного среднего отита. РМЖ. Медицинское обозрение. 2018;26(3 (II)):43-47.
Цель исследования: определить преимущества использования компьютерной навигации в хирургическом лечении пациентов с ХГСО.
Материал и методы: в условиях отделения оториноларингологии Клинического медицинского центра МГМСУ им. А. И. Евдокимова за 2015–2017 гг. пролечено 25 пациентов с ХГСО с применением компьютерной навигации. Всем пациентам было проведено хирургическое лечение открытым вариантом санирующих операций на среднем ухе с тимпанопластикой или без таковой в зависимости от распространенности процесса.
Результаты исследования: во всех случаях навигация способствовала хирургии, отображая остаточные пораженные воздушные ячейки. Особенно полезна была при работе с полостями ранее оперированных сосцевидных отростков. Во время операций система заверила полное вскрытие пораженных патологическим процессом клеток сосцевидного отростка, включая тегментальные и синодуральные клетки. Кроме того, система позволила, обнаружив фистулы лабиринта и обнаженной твердой мозговой оболочки, одномоментно выполнить пластику дефекта, избегая при этом повреждения окружающих структур. Каких-либо серьезных осложнений во время операций не наблюдалось.
Выводы: по нашему мнению, наибольшими преимуществами использования компьютерной навигации в хирургии ХГСО являются: более тщательное удаление патологического содержимого, бóльшая безопасность во время сложных манипуляций (особенно при измененной нормальной анатомии среднего уха), снижение количества осложнений за счет избегания травм нейроваскулярных структур, снижение кровопотери, продолжительности пребывания в стационаре, количества рецидивов и повторных операций и соответственно снижение затрат на лечение, а также улучшение функциональных результатов.
Ключевые слова: хронический гнойный средний отит, ХГСО, компьютерная навигация, навигационная поддержка, эпитимпанит, эпимезотимпанит, тимпанопластика.
Для цитирования: Овчинников А.Ю., Хон Е.М., Щербаков А.Ю. Компьютерная навигация в хирургии хронического гнойного среднего отита. РМЖ. Медицинское обозрение. 2018;26(3 (II)):43-47.
Computer navigation in the surgery of chronic suppurative otitis media
Ovchinnikov A.Yu., Khon E.M., Scherbakov A.Yu.
A. I. Yevdokimov Moscow State University of Medicine and Dentistry
Almost any form of chronic suppurative otitis media (CSOM) can be surgically treated.
The aim of the sudy is to determine the advantages of using computer navigation in the surgical treatment of patients with CSOM.
Patients and Methods: 25 patients with CSOM were treated with the use of computer navigation in 2015—2017 in the otorhinolaryngology department of Clinical Medical Center of A. I. Yevdokimov Moscow State University of Medicine and Dentistry. All patients were treated by an open middle ear surgery with tympanoplasty or without it depending on the prevalence of the process.
Results: in all cases, navigation contributed to surgery, displaying residual affected air cells. It was especially useful when we worked with the cavities of previously operated mastoids. During our operations, the system assured a complete dissection of the mastoid cells affected by the pathological process, including the tegmental and synodural cells. In addition, this allowed us, when finding a labyrinth fistula and dural exposure, to remove the found plastic defect at once, avoiding damage to surrounding structures. There were no serious complications during the operations.
Conclusions: in our opinion, the greatest advantages of using computer navigation in CSOM surgery are: more careful removal of pathological contents, greater safety during complex manipulations, especially with the altered normal anatomy of the middle ear, a reduction in the number of complications due to avoidance of traumas of neurovascular structures, lower blood loss, lower costs due to a decrease in the number of complications and length of stay in a hospital, a decrease in the number of relapses and the need for repeated operations, and also improvement of functional results.
Key words: chronic suppurative otitis media, CSOM, computer navigation, navigation support, attic disease, epimesotympanitis, tympanoplasty.
For citation: Ovchinnikov A.Yu., Khon E.M., Scherbakov A.Yu. Computer navigation in the surgery of chronic suppurative otitis media // RMJ. 2018. № 3(II). P. 43–47.
Ovchinnikov A.Yu., Khon E.M., Scherbakov A.Yu.
A. I. Yevdokimov Moscow State University of Medicine and Dentistry
Almost any form of chronic suppurative otitis media (CSOM) can be surgically treated.
The aim of the sudy is to determine the advantages of using computer navigation in the surgical treatment of patients with CSOM.
Patients and Methods: 25 patients with CSOM were treated with the use of computer navigation in 2015—2017 in the otorhinolaryngology department of Clinical Medical Center of A. I. Yevdokimov Moscow State University of Medicine and Dentistry. All patients were treated by an open middle ear surgery with tympanoplasty or without it depending on the prevalence of the process.
Results: in all cases, navigation contributed to surgery, displaying residual affected air cells. It was especially useful when we worked with the cavities of previously operated mastoids. During our operations, the system assured a complete dissection of the mastoid cells affected by the pathological process, including the tegmental and synodural cells. In addition, this allowed us, when finding a labyrinth fistula and dural exposure, to remove the found plastic defect at once, avoiding damage to surrounding structures. There were no serious complications during the operations.
Conclusions: in our opinion, the greatest advantages of using computer navigation in CSOM surgery are: more careful removal of pathological contents, greater safety during complex manipulations, especially with the altered normal anatomy of the middle ear, a reduction in the number of complications due to avoidance of traumas of neurovascular structures, lower blood loss, lower costs due to a decrease in the number of complications and length of stay in a hospital, a decrease in the number of relapses and the need for repeated operations, and also improvement of functional results.
Key words: chronic suppurative otitis media, CSOM, computer navigation, navigation support, attic disease, epimesotympanitis, tympanoplasty.
For citation: Ovchinnikov A.Yu., Khon E.M., Scherbakov A.Yu. Computer navigation in the surgery of chronic suppurative otitis media // RMJ. 2018. № 3(II). P. 43–47.
Статья посвящена возможностям компьютерной навигация в хирургии хронического гнойного среднего отита. Преимуществами ее использования являются: более тщательное удаление патологического содержимого, бóльшая безопасность во время сложных манипуляций, снижение количества осложнений, кровопотери, продолжительности пребывания в стационаре, количества рецидивов и повторных операций.
Введение
Практически любая форма хронического гнойного среднего отита (ХГСО) подлежит хирургическому лечению. Эта позиция в современной оториноларингологии в настоящее время является общепринятой [1, 2].Несмотря на детальное изучение проблемы, не решены вопросы неуклонного роста числа пациентов с ХГСО, госпитализируемых в ЛОР-стационары для проведения первичных и повторных вмешательств на среднем ухе, недостаточного освещения причин рецидивов заболевания, определения сроков планового этапного лечения пациентов с ХГСО, доступности слуховой реабилитации пациентов, перенесших различные хирургические вмешательства на среднем ухе, страдающих тугоухостью высокой степени. Эти вопросы побуждают к выявлению причин безуспешных случаев хирургического лечения патологии среднего уха, изменения алгоритма оказания помощи таким пациентам, в т. ч. внедрения в клиническую практику новых, современных высокотехнологичных методов реабилитации пациентов с ХГСО. На хирургический подход существенно повлияли финансовые аспекты современной системы здравоохранения, а также быстрый рост технических достижений в области медицины. Появились минимально инвазивные техники с акцентом на более раннее функциональное восстановление и косметический эффект [3], технологии, позволяющие видеть скрытые от глаз хирурга структуры. Развитие методов лучевой диагностики и информационных технологий привело к резкому усложнению технического оснащения в хирургии, включая сложнейшие робототехнические и компьютерные системы. Компьютерные навигационные станции появились как альтернатива широко известным стереотаксическим рамам, от использования которых в Европе уже давно отказались, за исключением процедуры глубокой стимуляции мозга [4].
В статье представлен наш опыт использования хирургической компьютерной навигационной системы Navigation Panel Unit NPU (Karl Storz, Germany) в качестве дополнения к хирургии ХГСО.
Navigation Panel Unit NPU относится к пассивным оптоэлектрическим хирургическим навигационным системам. Система оснащена камерой инфракрасного излучения. Инфракрасные лучи, направленные в сторону операционного поля, падают на рабочий инструмент хирурга. Весь хирургический инструментарий снабжен специальными сферами-маркерами. Испускаемый камерой луч отражается от этих маркеров и попадает обратно в камеру. По углу отражения луча система определяет местоположение и угол наклона инструмента. Используемый при этом процесс триангуляции схож с принципом действия GPS-навигации.
Цель исследования: определить преимущества использования компьютерной навигации в хирургическом лечении пациентов с ХГСО.
Материал и методы
В отделении оториноларингологии Клинического
медицинского центра МГМСУ им. А. И. Евдокимова за 2015–2017 гг. пролечено 25 пациентов: 16 (64%) мужчин и 9 (36%) женщин (средний возраст — 40,48±14,46 года) с ХГСО. Эпимезотимпанит выявлен у 15 (60%) пациентов, эпитимпанит — у 10 (40%). Во всех случаях санирующие операции выполнялись открытым способом на среднем ухе с тимпанопластикой или без таковой в зависимости от распространенности процесса. У 5 пациентов в анамнезе уже были санирующие операции, у 20 была первичная операция. Хирургическое лечение проведено с применением компьютерной навигации.
Система Navigation Panel Unit NPU состоит из рабочей станции Panel Unit NPU с сенсорным монитором, оптической камеры с двумя объективами, адаптера передачи данных, дисковода, устройства с фиксирующей лентой для отслеживания положения головы пациента, навигируемого щупа. Система Karl Storz NPU использует оптическую информацию, чтобы соотнести трехмерное (3D) компьютерное изображение пациента, построенное из предоперационной компьютерной томограммы (КТ) или магнитно-резонансной томограммы (МРТ), с хирургическим пространством в текущий момент времени. Перед хирургическим вмешательством каждый пациент имел от 4-х до 6 клейких координатных маркеров, являющихся по сути реперными точками, размещенными вокруг ушной раковины. Координатные маркеры прикреплялись к телу пациента перед КТ-исследованием, в дальнейшем они были хорошо видны на сканах и их легко можно было локализовать на теле пациента на этапе предоперационного планирования. Каждому пациенту выполнена мультиспиральная компьютерная томография со срезами в ортогональных проекциях с изотропным разрешением 0,5–1,0 мм, с обязательным включением всей верхней челюсти вместе с зубами. Изображения пациентов были сохранены в несжатом виде в формате DICOM.
Операционная требует определенного расположения оборудования при работе с навигацией: система NPU должна быть расположена у головы пациента, чтобы расстояние между навигационной камерой и устройством отслеживания пациента (трекером) было 0,8–1,1 м, поле зрения между ними не должно содержать преград (рис. 1).
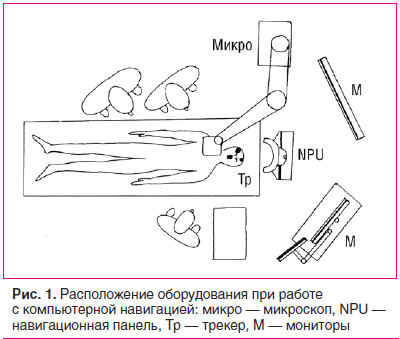
Предварительно проводился предоперационный этап планирования. Радиологические данные пациента импортировались в навигационную систему с компакт-диска/DVD, с USB-носителя или извлекались из внутренней памяти ранее загруженные данные. Навигационное программное обеспечение реконструировало данные изображений и генерировало автоматически заданные или требуемые проекции, а также трехмерную модель пациента. Выведенные на экран визуальные данные проверялись на правильность ориентации и полного включения операционного поля.
Следующим шагом на этапе планирования было позиционирование ориентиров на виртуальные данные пациента в режиме трехмерного изображения, с последующей корректировкой в двухмерных КТ-срезах. Ориентиры должны быть установлены на КТ-сканах так, чтобы затем они могли быть правильно локализованы во время совмещения с пациентом. Мы располагали ориентиры в местах нахождения координатных маркеров, установленных перед КТ-исследованием и хорошо отображаемых в 3D-проекции. В качестве альтернативы координатных маркеров использовались анатомические ориентиры: козелок, противозавиток, назион, латеральные углы обоих глаз, паз между резцами, место соединения перегородки носа и верхней губы, а в некоторых случаях латеральный отросток молоточка.
Следующим шагом в подготовке пациента была установка устройства отслеживания пациента — трекера. У 23 пациентов трекер был установлен и закреплен на голове с помощью фиксирующей ленты, у 2 пациентов — с помощью костного анкера. Что касается последнего, разрезы для его установки выполнялись кпереди от прикрепления височной мышцы на ипсилатеральной теменной кости во время нахождения пациента в наркозе. Специально сконструированные основания анкера через 3 разреза в коже головы устанавливались и крепились к теменной кости с помощью 2 мм винтов-саморезов. Перед сверлением исследовали 3D-реконструкцию черепа, чтобы удостовериться в адекватной толщине кортикальной кости в этой области. Свободный конец костного анкера (не проходящий через кожу) использовался в качестве регулируемого крепления для трекера, установленного на голове пациента. Трекер имеет Y-образную форму с тремя инфракрасными светоизлучающими диодами IREDs.
Следующим этапом регистрировался щуп, для чего его кончик помещали на точку регистрации, расположенную на трекере. Далее проводилась регистрация пациента —
совмещение виртуальной модели пациента с реальным пациентом, при помощи щупа находились анатомические ориентиры, установленные в режиме планирования, — четыре контрольные точки. Далее проверялась и подтверждалась регистрация пациента путем удержания щупа в хорошо опознаваемой анатомической структуре при неподвижном положении пациента в течение определенного времени. Если регистрация пациента выполнялась успешно, система переходила в режим хирургии: щуп выводился на экран во всех проекциях КТ-срезов. В ортогональных проекциях происходит отображение кончика щупа с помощью группы перекрестий.
Далее переходили непосредственно к санирующему этапу хирургического вмешательства. Все операции проводили заушным доступом. Доступ через мягкие ткани заушной области обеспечивал значительный обзор полостей среднего уха и позволял полноценно проводить ревизию и санацию. Кроме этого, такой хирургический доступ при минимальной дополнительной травме позволял производить забор собственных тканей пациента в качестве имплантационного материала. Большинство пациентов имели склеротический тип строения сосцевидного отростка, поэтому санирующее вмешательство начинали с удаления латеральной стенки аттика, далее по ходу распространения матрикса холестеатомы производили адито-антромастоидотомию, посредством удаления костных навесов обеспечивали значительный обзор лицевого и тимпанальных синусов, надтубарного углубления. Санирующее вмешательство производилось у всех пациентов практически по единому принципу — по ходу распространения матрикса холестеатомы при ее наличии. Периодически располагая навигационный щуп по контуру образовавшейся трепанационной полости, определяли наличие, оставшийся объем и локализацию пораженных невскрытых клеток, что облегчало выбор направления дальнейшей санации. Также это давало нам возможность максимально сохранять костные (опорные) структуры уха и минимизировать объем санирующего вмешательства, с целью уменьшения его влияния на исход возможного одномоментного реконструктивного этапа. Установка навигационного щупа относительно канала лицевого нерва, стенок крупных сосудов, височно-нижнечелюстного сустава, дна средней черепной ямки, сигмовидного синуса позволила нам точно определять местоположение критических структур, избегая их повреждения.
Результаты исследования
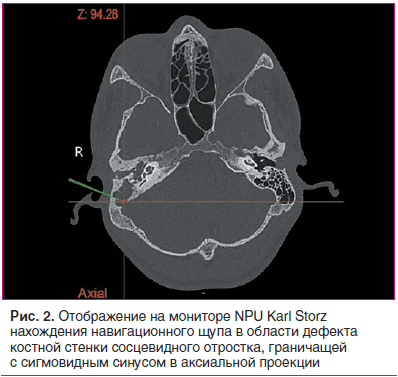
При проведении оперативного вмешательства с использованием компьютерной навигационной системы интраоперационно выявлены: кариозно-грануляционный процесс костных стенок полостей среднего уха у 24 (96%) пациентов; патологически измененная слизистая оболочка, наличие грануляций, рубцовый процесс в барабанной полости у 22 (88%) пациентов; холестеатома у 22 (88%) пациентов (хотя на дооперационном этапе она визуализировалась лишь у 19 (76%)). Сохраненные и инфицированные клетки сосцевидного отростка выявлены у всех ранее оперированных пациентов: в области верхушки сосцевидного отростка у 1 пациента, в области синодурального угла — у 1, тегментальные клетки — у 1, в области синодурального угла — у 2-х пациентов. Холестеатома в области atticus выявлена у 2-х пациентов (8%), atticus и aditus ad antrum — у 3-х (12%), atticus, aditus ad antrum и antrum mastoideum — у 6 (24%), antrum mastoideum и processus mastoideus — у 10 пациентов (40%). Еще у одного (4%) пациента холестеатома обнаружена только в cavi tympani. Костный навес над лицевым нервом на разных уровнях отсутствовал у 6 пациентов (24%), хотя его деструкция на дооперационном этапе была заподозрена лишь у 1 пациента. Фистула латерального полукружного канала выявлена у 2-х (8%) пациентов, деструкция костной стенки, отграничивающей сигмовидный синус, — у 2-х (8%) пациентов (рис. 2).Деструкция в области черепных ямок с обнажением dura mater наблюдалось в 7 (28%) случаях. В одном (4%) случае выявлен дефект передненижней стенки гипотимпанума, граничащей с внутренней сонной артерией.
Во всех случаях навигация способствовала хирургии, отображая остаточные пораженные воздушные ячейки. Особенно полезна была при работе с полостями ранее оперированных сосцевидных отростков. Во время наших операций система заверила полное вскрытие пораженных патологическим процессом клеток сосцевидного отростка, включая тегментальные и синодуральные клетки. Кроме того, это позволило нам при обнаружении фистулы лабиринта и обнаженной твердой мозговой оболочки одномоментно выполнить пластику дефекта, избегая при этом повреждения окружающих структур. Каких-либо серьезных осложнений во время операций
не наблюдалось.
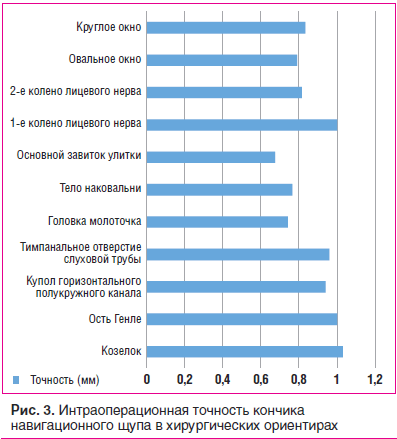
Время, затраченное на проведение предоперационной подготовки с регистрацией и проверкой и фактически увеличившее продолжительность операции, составило в среднем 15 мин. Средняя точность навигационной системы была в пределах 1 мм в 10 из 11 целевых хирургических анатомических ориентиров (рис. 3).
Обсуждение
С введением любой новой технологии в практику период адаптации неизбежен. Прежде чем станет возможным эффективное широкое использование технологии, необходимо решить вопросы, связанные с ее надлежащим применением, а недостатки устранить. Навигационные системы в хирургии среднего уха не исключение.Использование компьютерной навигации в хирургии среднего уха у пациентов с ХГСО весьма полезно, учитывая особенности анатомии органа. Во-первых, анатомия височной кости включает много костных анатомических ориентиров, не склонных к смещению, особенно интраоперационному [5–7]. Во-вторых, наличие в сложной анатомии височной кости многочисленных уязвимых структур сопровождается высоким риском осложнений при манипуляциях в этой области: повреждение лицевого нерва, улитки, полукружных каналов, твердой мозговой оболочки, сигмовидного синуса и сонной артерии [8]. В-третьих, нормальная анатомия может быть искажена с учетом изменений, вызванных болезнью или ранее проведенными операциями. Таким образом, анатомические ориентиры, используемые для направленной хирургии височной кости, могут отсутствовать или быть недостоверными [9]. И наконец, в‑четвертых, во время операции немалая часть времени и усилий тратится на верификацию и диссекцию жизненно важных структур среднего уха. Если же расположение жизненно важных структур устанавливается с помощью хирургического навигационного устройства, манипуляции становятся более точными и менее инвазивными. Однако есть и отрицательные моменты в использовании навигации в хирургии среднего уха: громоздкость оборудования и инструментария, с которыми приходится работать в пределах весьма ограниченного операционного поля, что увеличивает время операции и материально-технические затраты [10, 11].
Повторяющаяся тема дополнительных затрат, времени, неудобства и усилий, связанных с использованием стереотаксической навигации, подчеркивает насколько важно правильное его использование [12].
Тем не менее использование навигационных систем во время большинства манипуляций на височной кости весьма полезно повышением безопасности и подтверждением месторасположения жизненно важных структур. Соответствующие показания для применения этой технологии в хирургическом лечении пациентов с ХГСО еще предстоит определить.
Основной проблемой, касающейся применения хирургических навигационных систем в хирургии среднего уха, является их ограниченная точность. Височная кость — область, которая требует субмиллиметровой точности, но точность большинства навигационных систем находится в пределах 2 мм [6, 10, 12, 13]. Субмиллиметровая точность достигалась в трупных моделях, но не во время реальных операций [9, 14]. Полученные нами усредненные цифры точности колебались от 1,032 до 0,741 мм в зависимости от используемых настроек. Наибольшая точность была достигнута в случаях, когда использовался костный анкер.
Хотя мы наметили эффективные методы обеспечения максимальной точности этой системы, любая хирургическая навигационная система имеет свои ограничения. Вместе с тем ничто не может заменить дос-
конального знания анатомии. Навигационные системы ориентируют хирурга в идентификации структур и являются лишь дополнением к многолетнему опыту работы и знаниям.
Хирургические навигационные системы полезны для определения жизненно важных структур в среднем ухе, для выявления и направленной ревизии пораженных патологическим процессом клеток сосцевидного отростка, обнаженной твердой мозговой оболочки различных размеров и локализаций, ревизии канала лицевого нерва, костной стенки лабиринта, внутренней сонной артерии, луковицы яремной вены.
Выводы
По нашему мнению, наибольшими преимуществами использования компьютерной навигации в хирургии ХГСО являются: более тщательное удаление патологического содержимого, бóльшая безопасность во время сложных манипуляций при измененной нормальной анатомии среднего уха, снижение количества осложнений за счет избегания травм нейроваскулярных структур, снижение кровопотери, продолжительности пребывания в стационаре, количества рецидивов и повторных операций и соответственно снижение затрат на лечение, а также улучшение функциональных результатов.Хирургические навигационные системы являются дорогостоящими, требуют дополнительной предоперационной подготовки (тем самым увеличивая продолжительность операции), специального позиционирования в операционной. Поскольку эта технология продолжает развиваться, стоимость, вероятно, уменьшится, система станет проще в использовании, а время для настройки сократится. Тем не менее анализ затрат и выгод будет иметь решающее значение в эпоху управляемой медицинской помощи. Так как гибкость и полезность навигационных систем увеличивается, они должны стать стандартом лечения в хирургии ХГСО.
Литература
1. Крюков А. И., Ивойлов А. Ю., Захарова А. Ф. и др. Структура заболеваемости детей с госпитальной патологией ЛОР-органов по результатам мониторинга детских стационаров Москвы // Вестник оториноларингологии. 2015. № 4 (80). С.65–68 [Krjukov A.I., Ivojlov A. Ju., Zaharova A. F. i dr. Struktura zabolevaemosti detej s gospital’noj patologiej LOR-organov po rezul’tatam monitoringa detskih stacionarov Moskvy // Vestnik otorinolaringologii. 2015. № 4 (80). S.65–68 (in Russian)].
2. Косяков С. Я. Избранные вопросы практической отохирургии. М.: МЦФЭР. 2012. 224 с. [Kosjakov S. Ja. Izbrannye voprosy prakticheskoj otohirurgii. M.: MCFJeR. 2012. 224 s. (in Russian)].
3. Widmann G., Eisner W., Kovacs P. et al. Accuracy and clinical use of a novel aiming device for frameless stereotactic brain biopsy // Minimal Invasive Neurosurgery. 2008. Vol. 51 (6). P. 361–369.
4. Brown R. A., Roberts T. S., Osborn A. G. Stereotaxic frame and computer software for CT-directed neurosurgical localization // Investigative Radiology. 1980. Vol. 15. P.308–312.
5. Sargent E. W., Bucholz R. D. Middle cranial fossa surgery with image-guided instrumentation // Otolaryngology–Head and Neck Surgery. 1997. Vol.117. P.131–134.
6. Golfinos J. G., Fitzpatrick B. C., Smith L. R., Spetzler R. F. Clinical use of a frameless stereotactic arm: results of 325 cases // Journal of Neurosurgery. 1995. Vol. 83. P.197–295.
7. Dorward N. L., Alberti 0., Velani B. et al. Postimaging brain distortion: magnitudes, correlates, and impact on neuronavigation // Journal of Neurosurgery. 1998. Vol. 88. P.656–662.
8. Salvinelli F., De la Cruz A. Otoneurosurgery and lateral skull base surgery. Philadelphia: WB Saunders Co. 1996. 754 p.
9. Vrionis F. D., Foley K. T., Robertson J. H., Shea J. J. Use of cranial surface anatomic fiducials for interactive image-guided navigation in the temporal bone: a cadaveric study // Neurosurgery. 1997. Vol. 40. P.755–764.
10. Metson R., Cosenza M., Gliklich R. E., Montgomery W. W. The role of image-guidance systems for head and neck surgery // Archives of Otolaryngology - Head and Neck Surgery. 1999. Vol. 125. P.1100–1104.
11. Irving R. M., Proops D. W. The future of otology // The Journal of Laryngology and Otology. 2000. Vol. 114. P.3–5.
12. Selesnick S. H., Kacker A. Image-guided surgical navigation in otology and neurootology // American Journal of Otolaryngology. 1999. Vol. 20. P.688–697.
13. McDermott M.W., Gutin P. H. Image-guided surgery for skull base neoplasms using the ISG viewing wand: anatomic and technical considerations // Neurosurgery Clinics Of North America. 1996. Vol. 7. P.285–295.
14. Brinker T., Arango G., Kaminsky J. et al. An experimental approach to image-guided skull base surgery employing a microscope-based neuronavigation system // Acta Neurochirurgica. 1998. Vol. 140. P. 883–889.
2. Косяков С. Я. Избранные вопросы практической отохирургии. М.: МЦФЭР. 2012. 224 с. [Kosjakov S. Ja. Izbrannye voprosy prakticheskoj otohirurgii. M.: MCFJeR. 2012. 224 s. (in Russian)].
3. Widmann G., Eisner W., Kovacs P. et al. Accuracy and clinical use of a novel aiming device for frameless stereotactic brain biopsy // Minimal Invasive Neurosurgery. 2008. Vol. 51 (6). P. 361–369.
4. Brown R. A., Roberts T. S., Osborn A. G. Stereotaxic frame and computer software for CT-directed neurosurgical localization // Investigative Radiology. 1980. Vol. 15. P.308–312.
5. Sargent E. W., Bucholz R. D. Middle cranial fossa surgery with image-guided instrumentation // Otolaryngology–Head and Neck Surgery. 1997. Vol.117. P.131–134.
6. Golfinos J. G., Fitzpatrick B. C., Smith L. R., Spetzler R. F. Clinical use of a frameless stereotactic arm: results of 325 cases // Journal of Neurosurgery. 1995. Vol. 83. P.197–295.
7. Dorward N. L., Alberti 0., Velani B. et al. Postimaging brain distortion: magnitudes, correlates, and impact on neuronavigation // Journal of Neurosurgery. 1998. Vol. 88. P.656–662.
8. Salvinelli F., De la Cruz A. Otoneurosurgery and lateral skull base surgery. Philadelphia: WB Saunders Co. 1996. 754 p.
9. Vrionis F. D., Foley K. T., Robertson J. H., Shea J. J. Use of cranial surface anatomic fiducials for interactive image-guided navigation in the temporal bone: a cadaveric study // Neurosurgery. 1997. Vol. 40. P.755–764.
10. Metson R., Cosenza M., Gliklich R. E., Montgomery W. W. The role of image-guidance systems for head and neck surgery // Archives of Otolaryngology - Head and Neck Surgery. 1999. Vol. 125. P.1100–1104.
11. Irving R. M., Proops D. W. The future of otology // The Journal of Laryngology and Otology. 2000. Vol. 114. P.3–5.
12. Selesnick S. H., Kacker A. Image-guided surgical navigation in otology and neurootology // American Journal of Otolaryngology. 1999. Vol. 20. P.688–697.
13. McDermott M.W., Gutin P. H. Image-guided surgery for skull base neoplasms using the ISG viewing wand: anatomic and technical considerations // Neurosurgery Clinics Of North America. 1996. Vol. 7. P.285–295.
14. Brinker T., Arango G., Kaminsky J. et al. An experimental approach to image-guided skull base surgery employing a microscope-based neuronavigation system // Acta Neurochirurgica. 1998. Vol. 140. P. 883–889.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
