Радиохирургическое лечение рецидива злокачественной глиомы конвекситальной локализации с применением методики инфляции кожи в проекции новообразования (клинический случай)
РМЖ. Медицинское обозрение. №6 от 30.08.2018 стр. 41-45
Рубрика:
Онкология
Нейроэпителиальные опухоли самые часто встречающиеся первичные опухоли головного мозга. Несмотря на усилия нейрохирургов, нейроонкологов, радиологов, результаты лечения злокачественных глиом (ЗГ) следует признать по-прежнему плохими, а смертность при данной нозологии остается самой высокой среди онкологических больных.
Локализация нейроэпителиальных опухолей может ограничивать применение стереотаксической радиохирургии (СРХ) как метода однократного высокодозного облучения при рецидиве опухоли.
Последние 20 лет ведется интенсивная разработка альтернативных методов лечения рецидивирующих ЗГ, но значительного прогресса в лечении не достигнуто.
Ключевые слова: радиохирургия, гамма-нож, лучевая токсичность, глиома, инфляция.
Локализация нейроэпителиальных опухолей может ограничивать применение стереотаксической радиохирургии (СРХ) как метода однократного высокодозного облучения при рецидиве опухоли.
Последние 20 лет ведется интенсивная разработка альтернативных методов лечения рецидивирующих ЗГ, но значительного прогресса в лечении не достигнуто.
В статье представлен клинический случай лечения глиом методом СРХ. Устранение возможности повреждения кожи без увеличения длительности/стоимости лечения при сохранении радикальной циторедукции опухоли стало задачей нашей работы. Новый метод лечения позволяет сохранить высокую эффективность за счет обеспечения высокой предписанной дозы для патологического очага, а также высокий уровень безопасности за счет снижения дозовой нагрузки на кожу головы в проекции опухоли. Приведен клинический пример использования коллоидного раствора гидроксиэтилового крахмала, чем достигается его длительное (в течение 6–8 часов) «экспандерное» действие. Этого времени достаточно для планирования и проведения СРХ-лечения (с помощью установки «Гамма-нож»), а сходная с гликогеном биохимическая структура обеспечивает минимальный риск анафилактических реакций.
A.S. Tokarev, V.A. Rak, O.L. Evdokimova, K.V. Gretskikh
Sklifosovsky Scientific Research Institute of Emergency Care, Moscow
Neuroepithelial tumors are the most common primary brain tumors. Despite the efforts of neurosurgeons, neuro-oncologists, radiologists, the results of treating the patients with malignant gliomas (MG) are still poor, and mortality in this nosology remains the highest among cancer patients.
In the case of tumor recurrence, the localization of neuroepithelial tumors can limit the use of stereotactic radiosurgery (SRS) as a method of single high-dose irradiation.
Over the past 20 years, intensive development of alternative methods for the treatment of recurrent gliomas is underway, but significant progress in treatment is still not achieved.
The article presents a clinical case of SRS treatment of gliomas. Elimination of the possibility of scalp damage without increasing the duration / cost of treatment while maintaining radical tumor cytoreduction has become the task of this work. The new method of surgery allows maintaining a high efficacy by providing a high-dose prescription for the pathological focus, as well as a superior level of safety by reducing the dose to the scalp in the projection of the tumor.
Key words: radiosurgery, gamma knife, radiation toxicity, glioma, inflation.
For citation: Tokarev A.S., Rak V.A., Evdokimova O.L., Gretskikh K.V. Radiosurgical treatment method of convexital high grade glioma recurrence using the technique of skin inflation // RMJ. Medical Review. 2018. № 6. P. 41–45.
Sklifosovsky Scientific Research Institute of Emergency Care, Moscow
Neuroepithelial tumors are the most common primary brain tumors. Despite the efforts of neurosurgeons, neuro-oncologists, radiologists, the results of treating the patients with malignant gliomas (MG) are still poor, and mortality in this nosology remains the highest among cancer patients.
In the case of tumor recurrence, the localization of neuroepithelial tumors can limit the use of stereotactic radiosurgery (SRS) as a method of single high-dose irradiation.
Over the past 20 years, intensive development of alternative methods for the treatment of recurrent gliomas is underway, but significant progress in treatment is still not achieved.
The article presents a clinical case of SRS treatment of gliomas. Elimination of the possibility of scalp damage without increasing the duration / cost of treatment while maintaining radical tumor cytoreduction has become the task of this work. The new method of surgery allows maintaining a high efficacy by providing a high-dose prescription for the pathological focus, as well as a superior level of safety by reducing the dose to the scalp in the projection of the tumor.
A clinical example of the use of a colloidal solution of hydroxyethyl starch is given, than its prolonged (6–8 hours) «expander» effect is achieved. This period is enough for the planning and performing the SRS treatment (gamma-knife), and a biochemical structure similar to glycogen provides a minimal risk of anaphylactic reactions.
For citation: Tokarev A.S., Rak V.A., Evdokimova O.L., Gretskikh K.V. Radiosurgical treatment method of convexital high grade glioma recurrence using the technique of skin inflation // RMJ. Medical Review. 2018. № 6. P. 41–45.
Представлен клинический случай радиохирургического лечения рецидива злокачественной глиомы конвекситальной локализации с применением методики инфляции кожи в проекции новообразования.
Введение
Нейроэпителиальные опухоли астроцитарного и олигодендроглиального рядов (далее — глиомы) — самые часто встречающиеся первичные опухоли головного мозга (6 случаев на 100 тыс. населения) [1–5], при этом доля злокачественных глиом (ЗГ) среди них составляет около 20% [2]. Несмотря на усилия нейрохирургов, нейроонкологов и радиологов, результаты лечения по-прежнему приходится признать плохими, а смертность при данной нозологии остается самой высокой среди онкологических больных [6]. Особенно удручающе выглядит кривая выживаемости в группе больных с ЗГ, составляя, согласно недавним исследованиям, 18 мес. у мужчин и 15 мес. у женщин, а 5-летняя выживаемость встречается лишь в 5% наблюдений [2]. Применяемый в настоящее время мультимодальный стандарт лечения ЗГ включает в себя максимально безопасную хирургическую резекцию опухоли с последующими адъювантной химиотерапией, радиотерапией и стереотаксической радиохирургией (СРХ) в случае рецидива опухоли [7, 8]. Высокая эффективность и органосохраняющая направленность воздействия СРХ ведет к возрастанию ее роли в лечении ЗГ головного мозга. СРХ показана в случаях ограниченного очага рецидивирования ЗГ [9].При локализации патологического очага в функционально значимых и радиочувствительных зонах предпочтительным является применение стереотаксического однократного высокодозного облучения опухоли с помощью установки «Гамма-нож» как СРХ-метода, способного максимально сохранять здоровые ткани.
Одним из ограничений для подведения эффективной дозы при облучении ЗГ является конвекситальная локализация новообразования по причине высокой радиочувствительности кожи. По данным мировой литературы, допустимая, т. е. позволяющая избежать радиационно-индуцированного повреждения, доза для кожи составляет 8 Гр [10]. В соответствии с современными протоколами лечения диапазон эффективной краевой дозы при лечении рецидивов глиом высокой степени злокачественности составляет 18–26 Гр. Таким образом, в случае конвекситального расположения ЗГ достижение эффективного однократного лечения без лучевого повреждения кожи практически невозможно.
Нашей клиникой разрабатываются актуальные методы СРХ-лечения опухолей головного мозга конвекситальной локализации на аппарате «Гамма-нож», безвредные для кожных структур. Как результат мы предлагаем новый метод лечения при сохранении эффективности (за счет сохранения высокой предписанной дозы для патологического очага), радикальной циторедукции опухоли (без увеличения длительности/стоимости лечения), безопасности (за счет снижения дозовой нагрузки на кожу головы в проекции опухоли).
Нами использована инфляция кожи в проекции конвекситально расположенной опухоли с помощью биодеградируемого наполнителя, позволяющего спланировать СРХ-операцию с учетом смещения кожи. В качестве такого наполнителя мы применили подкожное введение коллоидного раствора гидроксиэтилового крахмала.
Клинический пример
Анамнез заболевания и данные дополнительных методов исследования. Пациентка М., 50 лет, поступила в отделение нейрохирургии НИИ СП им. Н.В. Склифосовского с рецидивом глиобластомы левой височной доли, индекс Карновского 80%, Recursive Partitioning Analysis 5. Из анамнеза известно, что 22.03.2016 в НИИ СП им. Н.В. Склифо-совского была выполнена операция: костно-пластическая трепанация черепа в левой височной области, микрохирургическое удаление опухоли левой височной доли. Гистологически — глиобластома. В послеоперационном периоде проведено комбинированное лечение: 3 курса препарата темозоломид в дозе 110 мг/м2, курс дистанционной лучевой терапии (ДЛТ) из 28 фракций по 2,0 Гр до суммарной очаговой дозы (СОД) 56 Гр. Спустя 1 год после ДЛТ выявлен очаг продолженного роста, который 16.08.2017 микрохирургически удален с использованием метаболической нейронавигации.
Через 4 мес. после повторной операции при МРТ головного мозга по периферии послеоперационной кисты (по переднему и наружному краю) выявлены очаги патологического повышения скорости тканевого церебрального кровотока в режиме бесконтрастной перфузии до 2-х раз в сравнении с интактной тканью (до 140 мл/мин). Очаги характеризовались неоднородным сигналом на нативных T1-взвешенных изображениях (Т1 ВИ), с наличием гиперинтенсивных включений, при внутривенном контрастном усилении они активно неоднородно накапливали контрастный препарат. По данным МР-спектроскопии, в очаге определялось выраженное повышение метаболита Cho (Choline 3.2 — холин) с соотношением Cho/NAA (метаболит NAA — NAA 2.0 — N-ацетиласпартат) до 6,0 (в норме — до 0,6).
По данным контрольной позитронно-эмиссионной компьютерной томографии (ПЭТ-КТ) головного мозга с 11С-метионином от октября 2017 г. определялся гипометаболический очаг в левой височной доле (послеоперационная киста) с участками повышенного накопления радиофармпрепарата (продолженный рост опухоли). Очагам повышенного накопления радиофармпрепарата на ПЭТ-КТ данных полностью соответствовали очаги гиперперфузии в левой височной доле, определяемые при МРТ головного мозга.
Учитывая неэффективность предшествующего комбинированного лечения и ограниченность очага рецидива, принято решение провести СРХ с краевой предписанной дозой 22 Гр и предписанной изодозой 50%.
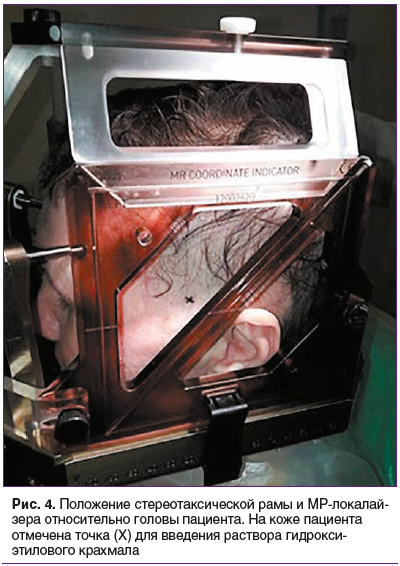
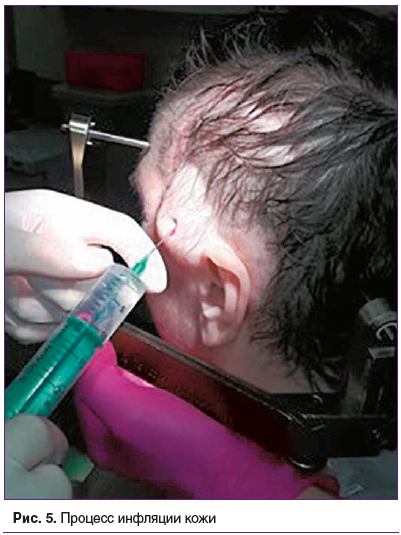
Наложена стереотаксическая рама, проведено МРТ головного мозга в режиме стереотаксической навигации, данные экспортированы в формате DICOM в программу планирования Leksell Gamma Plan 10.1. (рис. 1–3). Суммарный объем очагов составил 14 см3. На рис. 1 представлены распределения доз в облучаемой опухоли и прилегающих областях. Выявлено перекрытие прилегающего участка кожи головы изодозой 8 Гр. После определения координат точки введения раствора гидроксиэтилового крахмала нанесена метка на кожу головы пациента и произведена инфляция кожи с подкожным введением 15 мл гидроксиэтилового крахмала (рис. 4 и 5), при этом достигнуто увеличение расстояния между поверхностью кожи и подлежащей костью на 10 мм («экспандерный» эффект).
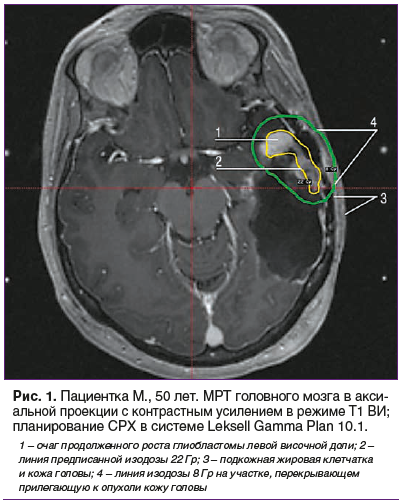
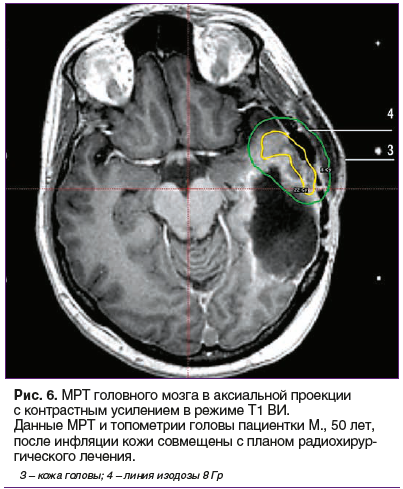
Повторно выполнена МРТ головного мозга, проведена коррекция плана радиохирургического лечения с учетом новых топометрических данных черепа и МРТ (рис. 6). Анализ кривых изодоз показал, что за счет инфляции, изодоза 8 Гр более не соприкасается с поверхностью кожи, прилегающей к опухоли, это позволило провести однофракционное дистанционное стереотаксически ориентированное облучение на аппарате Elekta Leksell Gamma Knife Perfexion («Гамма-нож»).
Обсуждение
Мультимодальный подход к лечению ЗГ включает применение хирургии/биопсии, химиотерапии и ДЛТ в различных комбинациях, в зависимости от локализации и распространенности процесса, а также соматического статуса пациента.Несмотря на выраженный ответ на лечение (до 80%) при стандартном подходе [10], частота рецидивов остается высокой, а медиана выживаемости колеблется в пределах 12–18 мес. [4].
Увеличение продолжительности жизни удается получить при комбинированной высокодозной химиотерапии совместно с лучевой терапией [3, 7], что, однако, неизбежно сопряжено с выраженными токсическими осложнениями и значительным снижением качества жизни [8, 9].
Последние 20 лет ведется интенсивная разработка альтернативных методов лечения рецидивирующих ЗГ, это: интраоперационная фотодинамическая терапия [11], интраоперационная лучевая терапия [12, 13], брахитерпия [14], внешнее электромагнитное модулирование [15–17], онколитическая вирусная терапия [18]. Но несмотря на появление новых методик, значительного прогресса в лечении ЗГ по-прежнему не достигнуто.
Одним из перспективных методов является СРХ, которая при верно выбранном подходе и тщательном отборе больных может, помимо хорошей переносимости, дать удовлетворительную частоту локального контроля (до 79%), увеличение общей выживаемости и времени до ухудшения неврологической симптоматики [6]. СРХ особенно эффективна при показателях индекса Карновского от 80% и выше, при небольших локальных и дистантных рецидивах (диаметром до 30 мм), а также в период после ДЛТ.
Однако, несмотря на некоторый прогресс в развитии СРХ, отбор больных по-прежнему остается индивидуальным, не сформулированы четкие показания к этому виду лечения, а молекулярное и гистологическое разнообразие злокачественных опухолей, наряду с широкой палитрой применяемых методов лечения ЗГ, ощутимо усложняет и затрудняет анализ эффективности комбинированного лечения. Эффективность же СРХ в лечении впервые выявленной ЗГ и вовсе остается неясной, особо требуя дальнейших исследований.
Тем не менее, несмотря на все ныне существующие
комбинации методик контроля роста ЗГ, СРХ можно
рекомендовать при рецидивировании удаленной опухоли. Кроме того, СРХ можно повторять многократно (за счет отсутствия выраженных токсических эффектов) до слишком большого размера очага рецидива, когда радиохирургическое лечение уже становится невозможным. СРХ может стать методом выбора также при рецидивах рядом с элоквентными зонами, когда повторная резекция опухоли невозможна, а сроки проведения ДЛТ не позволяют провести ее повторный курс, т. к. большинство рецидивов ЗГ проявляет себя уже в первые 4 мес. после удаления опухоли. Но в данном случае обязательным, по нашему мнению, является применение методов картирования элоквентных зон на этапе планирования СРХ, например функциональной МРТ или транскраниальной магнитной стимуляции [19, 20]. При СРХ фокальных конвекситальных рецидивов требуется обеспечить надежную защиту структур кожи от воздействия ионизирующей радиации (ИР). Даже несмотря на высокий градиент дозы при СРХ, на расстоянии менее 1 см от края опухоли радиочувствительные ткани, а именно кожные покровы, иногда получают дозу достаточную для лучевого повреждения.
Кожа относится к органам, имеющим средние показатели чувствительности к ИР. Самыми чувствительными к ИР являются клетки базального слоя кожи, волосяных луковиц, сальных и потовых желез.
Основной эффект повреждающего действия ИР заключается в нарушении трофики, что замедляет или останавливает физиологическую регенерацию элементов кожи. На клеточном уровне это выглядит как расстройство митотических процессов (многоядерность клеток, кариопикноз или гидратация ядер, что особенно опасно в клеточной фазе G2M, когда клетка чрезвычайно чувствительна к воздействию ИР). Морфологически процесс сопровождается атрофией или деструкцией волосяных фолликулов, дистрофией или атрофией сальных желез, дистрофией эпидермиса (гиперкератоз или истончение, поражение ногтей), нарушением микроциркуляции в кровеносных и лимфатических сосудах, нарушением коагуляционных свойств крови [21].
Клинически принято выделять ранние и поздние лучевые кожные повреждения. К ранним относятся лучевые ожоги, к поздним — хронический лучевой дерматит (эритема, отек дермы и интерстициальный отек, алопеция), лучевой фиброз (плотная отечная инфильтрация кожи), поздняя лучевая язва. По некоторым данным, в отдаленном периоде после воздействия ИР возможно развитие саркомы мягких тканей, однако ее связь с ИР имеет низкий уровень достоверности, в качестве причины ее появления также не исключается наследственная или приобретенная предрасположенность организма к онкогенезу [22].
Все вышеизложенное потребовало разработки методик по защите кожи от повреждающего действия ИР.
При СРХ-лечении на аппарате «Гамма-нож» распределение доз делает бессмысленным применение внешних защитных экранов, а снижение предписанной дозы с блокировкой «кожно-ориентированных» пучков излучения и использование методов гипофракционирования приводит к снижению эффекта самого лечения или увеличивает его продолжительность.
В настоящий момент доступно большое разнообразие тканевых экспандеров из эластичных полимерных материалов для клинического применения, способных достаточно растянуть кожу на целевом участке [8, 9]. Однако применение для СРХ такого аппарата, как «Гамма-нож», делает нецелесообразным использование инвазивной техники размещения экранов длительного применения в связи с возможностью однократного облучения патологического очага высокой дозой ИР.
Заключение
В результате нашей работы мы добились устранения самой возможности повреждения кожи без увеличения длительности/стоимости лечения и при сохранении радикальной циторедукции опухоли. Для решения этой задачи подходит малоинвазивная техника инфляции кожи в проекции конвекситально расположенной опухоли с применением биодеградируемого наполнителя. В качестве такового может быть употреблен любой коллоидный инфузионный раствор со средней или высокой молекулярной массой. В рамках данной работы приведен клинический пример успешного использования коллоидного раствора гидроксиэтилового крахмала с молекулярной массой 130 000 Да, чем достигается его длительное (в течение6–8 часов) «экспандерное» действие. Этого времени достаточно для планирования и проведения СРХ-лечения, а сходная с гликогеном биохимическая структура обеспечивает минимальный риск анафилактических реакций.
Малоинвазивная инфляция кожи в проекции конвекситально расположенной ЗГ перед проведением однофракционного дистанционного стереотаксически ориентированного облучения может стать методикой, позволяющей, при сохранении сроков и качества СРХ, обеспечить профилактику воздействия ИР на кожу головы пациента.
Литература
1. Tumors of the Central Nervous System / ed. by Hayat M.A. New York: Springer. 2011. 456 p.
2. Primary central nervous system tumors: pathogenesis and therapy / ed. by Norden A.D., Reardon D.A, Wen P.Y. Humana Press. 2011. 568p. doi: 10.1007/978-1-60761-166-0
3. Wang Y., Li S., Chen L. et al. Glioblastoma with an oligodendroglioma component: distinct clinical behavior, genetic alterations, and outcome // Neuro Oncol. 2012. Vol. 14(4). P.518–525. doi:10.1093/neuonc/nor232
4. Goda J.S., Lewis S., Agarwal A. et al. Impact of oligodendroglial component in glioblastoma (GBM-O): Is the outcome favourable than glioblastoma // Clin. Neurol. Neurosurg. 2015. Vol. 135. P.46–53. doi:10.1016/j.clineuro. 2015.05.005
5. Павлова Г.В., Баклаушев В.П., Иванова М.А. и др. Современные молекулярные подходы к диагностике и лечению низкодифференцированных глиом // Журнал Вопросы нейрохирургии. 2014. №6. С.85–100 [Pavlova G.V., Baklaushev V.P., Ivanova M.A. i dr. Sovremennye molekuljarnye podhody k diagnostike i lecheniju nizkodifferencirovannyh gliom // Zhurnal Voprosy nejrohirurgii. 2014. №6. S.85–100 (in Russian)].
6. Нейрорадиохирургия на гамма-ноже / под ред. А.В. Голованова, В.В. Костюченко. М.: Из-во Т.А. Алексеева. 2018. 960 с. [Nejroradiohirurgija na gamma-nozhe / pod red. A.V. Golovanova, V.V. Kostjuchenko. M.: Izd-vo T.A. Alekseeva. 2018. 960 s. (in Russian)].
7. Клинические рекомендации по лечению первичных опухолей центральной нервной системы. Стандарты, рекомендации и опции в лечении опухолей головного мозга у взрослых [Электронный ресурс] / под ред. О.В. Абсалямова, О.Ю. Аникеева, А.В. Голанов и др. М.: Ассоциация нейрохирургов России. 2013. URL: http://ruans.org/files/pdf/guidelines/tumors.pdf (дата обращения: 30.08.2018) [Klinicheskie rekomendacii po lecheniju pervichnyh opuholej central’noj nervnoj sistemy. Standarty, rekomendacii i opcii v lechenii opuholej golovnogo mozga u vzroslyh [Jelektronnyj resurs] / pod red. O.V. Absaljamova, O.Ju. Anikeeva, A.V. Golanov i dr. M: Associacija nejrohirurgov Rossii. 2013. URL: http://ruans.org/files/pdf/guidelines/tumors.pdf (data obrashhenija: 30.08.2018) (in Russian)].
8. Stupp R., Hegi M.E., Mason W.P. et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial // Lancet Oncol. 2009. Vol. 10(5). P.459–466. doi:10.1016/S1470-2045(09)70025-7
9. Malmstrom A., Gronberg B.H., Marosi C. et al. Temozolomide versus standard 6-week radiotherapy versus hypofractionated radiotherapy in patients older than 60 years with glioblastoma: the Nordic randomised, phase 3 trial // Lancet Oncol. 2012. Vol. 13(9). P.916–926. doi:10.1016/S1470-2045(12)70265-6
10. Bradford C.D., Morabito B., Shearer D.R. et al. Radiation-induced epilation due to couch transit dose for the Leksell Gamma Knife model C // Int. J. Radiation Oncology Biol. Phys. 2002. Vol. 54(4). P.1134–1139. PMID:12419440.
11. Куржупов М.И., Лошаков В.А., Филоненко Е.В. и др. Интраоперационная флюоресцентная диагностика и фотодинамическая терапия у больных с метастатическим поражением головного мозга // Журнал Вопросы нейрохирургии. 2012. Т.76. №2. С.50–57 [Kurzhupov M.I., Loshakov V.A., Filonenko E.V., i dr. Intraoperacionnaja fljuorescentnaja diagnostika i fotodinamicheskaja terapija u bol’nyh s metastaticheskim porazheniem golovnogo mozga // Zhurnal Voprosy nejrohirurgii. 2012. T.76. №2. S.50–57 (in Russian)].
12. Giordano F.A., Brehmer S., Abo-Madyan Y. et al. INTRAGO: intraoperative radiotherapy in glioblastoma multiforme — a Phase I/II dose escalation study // BMC Cancer. 2014. Vol.14. P.992. doi: 10.1186/1471-2407-14-992.
13. Leksell Gamma Knife Society. Treatment Statistics Report 1968–2017 [Электронный ресурс] // 2017. URL:https://www.lgksociety.com/fileadmin/groups/1/Documents/Treatment_Statistics/2017/1968-2017_Indicati... (дата обращения: 30.08.2018).
14. Ruge M.I., Simon T., Suchorska B. et al. Stereotactic Brachytherapy With Iodine-125 Seeds for the Treatment of Inoperable Low-Grade Gliomas in Children: Long-Term Outcome // J. Clin. Oncol. 2011. Vol. 29(31). P.4151–4159. doi:10.1200/JCO.2011.37.3381
15. Bloch O., Han S.J., Cha S. et al. Impact of extent of resection for recurrent glioblastoma on overall survival: clinical article // J. Neurosurg. 2012. Vol. 117(6). P.1032–1038. doi:10.3171/2012.9.JNS12504
16. Krieg S.M., Shiban E., Buchmann N. et al. Utility of presurgical navigated transcranial magnetic brain stimulation for the resection of tumors in eloquent motor areal // J. Neurosurg. 2012. Vol.116(5). P.994–1001. doi:10.3171/2011.12.JNS111524
17. Tarapore P.E., Martino J., Guggisberg A. et al. Magnetoencephalographic Imaging of Resting-State Functional Connectivity Predicts Postsurgical Neurological Outcome in Brain Gliomas // Neurosurgery. 2012. Vol.71(5). P.1012–1022. doi:10.1186/1471-2407-14-992
18. Сосновцева А.О., Гриненко Н.Ф., Липатова А.В. и др. Онколитические вирусы в терапии злокачественных глиом // Биомедицинская химия. 2016. Т.62. вып. 4. С.376–390 [Sosnovceva A.O., Grinenko N.F., Lipatova A.V. i dr. Onkoliticheskie virusy v terapii zlokachestvennyh gliom // Biomedicinskaja himija. 2016. T.62. vyp.4. S.376–390 (in Russian)].
19. Токарев А.С., Степанов В.Н., Шатохина Ю.И. и др. Применение функциональной магнитно-резонансной томографии головного мозга в нейрохирургии // Нейрохирургия. 2017. №2. С.3–10 [Tokarev A.S., Stepanov V.N., Shatohina Ju.I., i dr. Primenenie funkcional’noj magnitno-rezonansnoj tomografii golovnogo mozga v nejrohirurgii // Nejrohirurgija. 2017. №2. S.3–10 (in Russian)].
20. Токарев А.С., Чувилин С.А., Степанов В.Н., Рак В.А. Роль функциональной магнитно-резонансной томографии при удалении опухолей в функционально значимых зонах головного мозга. Наблюдение из практики // Нейрохирургия. 2017. №3. С.64–69 [Tokarev A.S., Chuvilin S.A., Stepanov V.N., Rak V.A. Rol’ funkcional’noj magnitno-rezonansnoj tomografii pri udalenii opuholej v funkcional’no znachimyh zonah golovnogo mozga. Nabljudenie iz praktiki // Nejrohirurgija. 2017. №3. S.64–69 (in Russian)].
21. Ahmad S.S., Duke S., Jena R. et al. Advances in radiotherapy // BMJ. 2012. Vol. 345. doi: 10.1136/bmj.e7765
22. Connell P.P., Hellman S. Advances in radiotherapy and implications for the next century: a historical perspective // Cancer Res. 2009. Vol.69(2). P.83–392. doi:10.1158/0008-5472.CAN-07-6871
2. Primary central nervous system tumors: pathogenesis and therapy / ed. by Norden A.D., Reardon D.A, Wen P.Y. Humana Press. 2011. 568p. doi: 10.1007/978-1-60761-166-0
3. Wang Y., Li S., Chen L. et al. Glioblastoma with an oligodendroglioma component: distinct clinical behavior, genetic alterations, and outcome // Neuro Oncol. 2012. Vol. 14(4). P.518–525. doi:10.1093/neuonc/nor232
4. Goda J.S., Lewis S., Agarwal A. et al. Impact of oligodendroglial component in glioblastoma (GBM-O): Is the outcome favourable than glioblastoma // Clin. Neurol. Neurosurg. 2015. Vol. 135. P.46–53. doi:10.1016/j.clineuro. 2015.05.005
5. Павлова Г.В., Баклаушев В.П., Иванова М.А. и др. Современные молекулярные подходы к диагностике и лечению низкодифференцированных глиом // Журнал Вопросы нейрохирургии. 2014. №6. С.85–100 [Pavlova G.V., Baklaushev V.P., Ivanova M.A. i dr. Sovremennye molekuljarnye podhody k diagnostike i lecheniju nizkodifferencirovannyh gliom // Zhurnal Voprosy nejrohirurgii. 2014. №6. S.85–100 (in Russian)].
6. Нейрорадиохирургия на гамма-ноже / под ред. А.В. Голованова, В.В. Костюченко. М.: Из-во Т.А. Алексеева. 2018. 960 с. [Nejroradiohirurgija na gamma-nozhe / pod red. A.V. Golovanova, V.V. Kostjuchenko. M.: Izd-vo T.A. Alekseeva. 2018. 960 s. (in Russian)].
7. Клинические рекомендации по лечению первичных опухолей центральной нервной системы. Стандарты, рекомендации и опции в лечении опухолей головного мозга у взрослых [Электронный ресурс] / под ред. О.В. Абсалямова, О.Ю. Аникеева, А.В. Голанов и др. М.: Ассоциация нейрохирургов России. 2013. URL: http://ruans.org/files/pdf/guidelines/tumors.pdf (дата обращения: 30.08.2018) [Klinicheskie rekomendacii po lecheniju pervichnyh opuholej central’noj nervnoj sistemy. Standarty, rekomendacii i opcii v lechenii opuholej golovnogo mozga u vzroslyh [Jelektronnyj resurs] / pod red. O.V. Absaljamova, O.Ju. Anikeeva, A.V. Golanov i dr. M: Associacija nejrohirurgov Rossii. 2013. URL: http://ruans.org/files/pdf/guidelines/tumors.pdf (data obrashhenija: 30.08.2018) (in Russian)].
8. Stupp R., Hegi M.E., Mason W.P. et al. Effects of radiotherapy with concomitant and adjuvant temozolomide versus radiotherapy alone on survival in glioblastoma in a randomised phase III study: 5-year analysis of the EORTC-NCIC trial // Lancet Oncol. 2009. Vol. 10(5). P.459–466. doi:10.1016/S1470-2045(09)70025-7
9. Malmstrom A., Gronberg B.H., Marosi C. et al. Temozolomide versus standard 6-week radiotherapy versus hypofractionated radiotherapy in patients older than 60 years with glioblastoma: the Nordic randomised, phase 3 trial // Lancet Oncol. 2012. Vol. 13(9). P.916–926. doi:10.1016/S1470-2045(12)70265-6
10. Bradford C.D., Morabito B., Shearer D.R. et al. Radiation-induced epilation due to couch transit dose for the Leksell Gamma Knife model C // Int. J. Radiation Oncology Biol. Phys. 2002. Vol. 54(4). P.1134–1139. PMID:12419440.
11. Куржупов М.И., Лошаков В.А., Филоненко Е.В. и др. Интраоперационная флюоресцентная диагностика и фотодинамическая терапия у больных с метастатическим поражением головного мозга // Журнал Вопросы нейрохирургии. 2012. Т.76. №2. С.50–57 [Kurzhupov M.I., Loshakov V.A., Filonenko E.V., i dr. Intraoperacionnaja fljuorescentnaja diagnostika i fotodinamicheskaja terapija u bol’nyh s metastaticheskim porazheniem golovnogo mozga // Zhurnal Voprosy nejrohirurgii. 2012. T.76. №2. S.50–57 (in Russian)].
12. Giordano F.A., Brehmer S., Abo-Madyan Y. et al. INTRAGO: intraoperative radiotherapy in glioblastoma multiforme — a Phase I/II dose escalation study // BMC Cancer. 2014. Vol.14. P.992. doi: 10.1186/1471-2407-14-992.
13. Leksell Gamma Knife Society. Treatment Statistics Report 1968–2017 [Электронный ресурс] // 2017. URL:https://www.lgksociety.com/fileadmin/groups/1/Documents/Treatment_Statistics/2017/1968-2017_Indicati... (дата обращения: 30.08.2018).
14. Ruge M.I., Simon T., Suchorska B. et al. Stereotactic Brachytherapy With Iodine-125 Seeds for the Treatment of Inoperable Low-Grade Gliomas in Children: Long-Term Outcome // J. Clin. Oncol. 2011. Vol. 29(31). P.4151–4159. doi:10.1200/JCO.2011.37.3381
15. Bloch O., Han S.J., Cha S. et al. Impact of extent of resection for recurrent glioblastoma on overall survival: clinical article // J. Neurosurg. 2012. Vol. 117(6). P.1032–1038. doi:10.3171/2012.9.JNS12504
16. Krieg S.M., Shiban E., Buchmann N. et al. Utility of presurgical navigated transcranial magnetic brain stimulation for the resection of tumors in eloquent motor areal // J. Neurosurg. 2012. Vol.116(5). P.994–1001. doi:10.3171/2011.12.JNS111524
17. Tarapore P.E., Martino J., Guggisberg A. et al. Magnetoencephalographic Imaging of Resting-State Functional Connectivity Predicts Postsurgical Neurological Outcome in Brain Gliomas // Neurosurgery. 2012. Vol.71(5). P.1012–1022. doi:10.1186/1471-2407-14-992
18. Сосновцева А.О., Гриненко Н.Ф., Липатова А.В. и др. Онколитические вирусы в терапии злокачественных глиом // Биомедицинская химия. 2016. Т.62. вып. 4. С.376–390 [Sosnovceva A.O., Grinenko N.F., Lipatova A.V. i dr. Onkoliticheskie virusy v terapii zlokachestvennyh gliom // Biomedicinskaja himija. 2016. T.62. vyp.4. S.376–390 (in Russian)].
19. Токарев А.С., Степанов В.Н., Шатохина Ю.И. и др. Применение функциональной магнитно-резонансной томографии головного мозга в нейрохирургии // Нейрохирургия. 2017. №2. С.3–10 [Tokarev A.S., Stepanov V.N., Shatohina Ju.I., i dr. Primenenie funkcional’noj magnitno-rezonansnoj tomografii golovnogo mozga v nejrohirurgii // Nejrohirurgija. 2017. №2. S.3–10 (in Russian)].
20. Токарев А.С., Чувилин С.А., Степанов В.Н., Рак В.А. Роль функциональной магнитно-резонансной томографии при удалении опухолей в функционально значимых зонах головного мозга. Наблюдение из практики // Нейрохирургия. 2017. №3. С.64–69 [Tokarev A.S., Chuvilin S.A., Stepanov V.N., Rak V.A. Rol’ funkcional’noj magnitno-rezonansnoj tomografii pri udalenii opuholej v funkcional’no znachimyh zonah golovnogo mozga. Nabljudenie iz praktiki // Nejrohirurgija. 2017. №3. S.64–69 (in Russian)].
21. Ahmad S.S., Duke S., Jena R. et al. Advances in radiotherapy // BMJ. 2012. Vol. 345. doi: 10.1136/bmj.e7765
22. Connell P.P., Hellman S. Advances in radiotherapy and implications for the next century: a historical perspective // Cancer Res. 2009. Vol.69(2). P.83–392. doi:10.1158/0008-5472.CAN-07-6871

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья

