Сосудистый паркинсонизм: 20 лет спустя
РМЖ. №21 от 24.10.2017 стр. 1500-1506
Рубрика:
Неврология
В 1997 году в Неврологическом журнале была напечатана статья "Сосудистый паркинсонизм". В данной статье представлены современные представления о сосудистом паркинсонизме (СП), явившиеся итогом 20-летнего исследования данной проблемы. Подробно рассматриваются этиология, особенности клинического течения. Особое внимание уделено клинической гетерогенности синдрома, роли поражения мелких артерий в его патогенезе, причинно-следственной связи между сосудистой патологией головного мозга и клиническими проявлениями. Авторами выдвигаются критерии диагностики СП, пригодные для повседневной клинической практики. Отдельно рассматриваются особенности течения комбинации болезни Паркинсона (БП) и цереброваскулярного заболевания. Рассмотрены современные направления в диагностике и лечении СП. Исходя из общеклинических соображений, выделяют два основных направления в лечении СП: базисную терапию, направленную на предупреждение дальнейшего повреждения мозга, и симптоматическую терапию, направленную на коррекцию паркинсонизма и сопутствующих проявлений. Возможности стереотаксических вмешательств при СП систематически не изучены. У некоторых больных с ограниченным поражением базальных ганглиев они могут быть эффективными. Однако, как показывает опыт стереотаксических вмешательств при мультисистемных дегенерациях, экстранигральных формах паркинсонизма и мультифокальном поражении мозга, разработанные к настоящему времени стереотаксические операции чаще оказываются неэффективными.
Ключевые слова: паркинсонизм, болезнь малых сосудов, сосудистый паркинсонизм, дисбазия, леводопа.
Для цитирования: Левин О.С. Сосудистый паркинсонизм: 20 лет спустя. РМЖ. Медицинское обозрение. 2017;25(21):1500-1506.
Ключевые слова: паркинсонизм, болезнь малых сосудов, сосудистый паркинсонизм, дисбазия, леводопа.
Для цитирования: Левин О.С. Сосудистый паркинсонизм: 20 лет спустя. РМЖ. Медицинское обозрение. 2017;25(21):1500-1506.
Vascular parkinsonism: 20 years later
Levin O.S.
Russian Medical Academy of Continuous Professional Education, Moscow
20 years ago author published review paper «Vascular parkinsonism». This article presents modern ideas about the clinical picture and the diagnosis of vascular parkinsonism (VP). The etiology of the disease, the features of the clinical course are considered in detail. Particular attention is paid to the clinical heterogeneity of the syndrome, the role of small arteries lesions in its pathogenesis, the establishment of a causal relationship between cerebral vascular pathology and clinical manifestations. The authors put forward criteria for diagnosis of VP, suitable for everyday clinical practice. The features of the course of the combination of Parkinson's and cerebrovascular disease are considered. Modern trends in the diagnosis of vascular parkinsonism treatment are given. Based on general clinical considerations, there are two main areas in the treatment of VP: basic therapy aimed at preventing further brain damage, and symptomatic therapy aimed at correcting parkinsonism and concomitant manifestations. The possibilities of stereotaxic interventions in VP have not been systematically studied yet. In some patients with limited basal ganglia lesions, they can be effective, but as the experience with stereotaxic interventions in multi-systemic degenerations shows, stereotaxic operations are often ineffective in extranigral forms of parkinsonism and multifocal brain damage.
Key words: parkinsonism, small vascular disease, vascular parkinsonism, dysbasia, levodopa.
For citation: Levin O.S. Vascular parkinsonism: 20 years later // RMJ. 2017. № 21. P. 1500–1506.
Levin O.S.
Russian Medical Academy of Continuous Professional Education, Moscow
20 years ago author published review paper «Vascular parkinsonism». This article presents modern ideas about the clinical picture and the diagnosis of vascular parkinsonism (VP). The etiology of the disease, the features of the clinical course are considered in detail. Particular attention is paid to the clinical heterogeneity of the syndrome, the role of small arteries lesions in its pathogenesis, the establishment of a causal relationship between cerebral vascular pathology and clinical manifestations. The authors put forward criteria for diagnosis of VP, suitable for everyday clinical practice. The features of the course of the combination of Parkinson's and cerebrovascular disease are considered. Modern trends in the diagnosis of vascular parkinsonism treatment are given. Based on general clinical considerations, there are two main areas in the treatment of VP: basic therapy aimed at preventing further brain damage, and symptomatic therapy aimed at correcting parkinsonism and concomitant manifestations. The possibilities of stereotaxic interventions in VP have not been systematically studied yet. In some patients with limited basal ganglia lesions, they can be effective, but as the experience with stereotaxic interventions in multi-systemic degenerations shows, stereotaxic operations are often ineffective in extranigral forms of parkinsonism and multifocal brain damage.
Key words: parkinsonism, small vascular disease, vascular parkinsonism, dysbasia, levodopa.
For citation: Levin O.S. Vascular parkinsonism: 20 years later // RMJ. 2017. № 21. P. 1500–1506.
В статье представлены современные представления о сосудистом паркинсонизме
Впервые мысль о том, что паркинсонизм может быть следствием сосудистого заболевания мозга, высказал, по-видимому, французский невролог Е. Brissaud (1894), который предположил, что субстратом паркинсонизма служит дегенерация черной субстанции или любое иное поражение этой структуры, в т. ч. и сосудистого генеза. В 1929 г., обобщив собственные наблюдения и имевшиеся к тому времени литературные данные, 29-летний Макдональд Критчли (М. Сritchley), впоследствии ставший знаменитейшим американским неврологом, сделал первое подробное описание «артериосклеротического паркинсонизма» [1].Ввиду отсутствия четких диагностических критериев и убедительных патоморфологических исследований проблема сосудистого паркинсонизма (СП) длительное время остается предметом дискуссий. Одни исследователи отрицали саму возможность существования СП, полагая, что при сосудистом поражении мозга невозможны истинная акинезия и ригидность, а паркинсоническую симптоматику лишь имитируют спастичность, псевдобульбарный синдром или паратония (в связи с этим для обозначения паркинсоноподобных нарушений сосудистого генеза нередко использовался термин «сосудистый, или атеросклеротический псевдопаркинсонизм»). В других ситуациях диагностировали «псевдососудистый паркинсонизм» (например, у больных с дегенеративным паркинсонизмом и сопутствующим цереброваскулярным заболеванием (ЦВЗ)) и даже «псевдососудистый псевдопаркинсонизм» (например, у больных с нарушением ходьбы вследствие нормотензивной гидроцефалии) [2]. В отечественной неврологии длительное время отмечалась тенденция к гипердиагностике СП, связанная с нечеткостью клинических критериев СП и, в частности, переоценкой диагностической значимости сосудистых факторов риска или отдельных признаков цереброваскулярной недостаточности, часто встречающихся у пожилых лиц. В 1997 г. авторы подготовили обзор исследований по СП, опубликованный в «Неврологическом журнале». За 20 лет, прошедших с того времени, появились новые публикации, которые существенно изменили представления о проблеме СП. В данной статье отражены эти изменения.
Появление компьютерной томографии (КТ) и особенно магнитно-резонансной томографии (МРТ) упростило диагностику сосудистых поражений мозга, но вместе с тем создало своего рода диагностическую «ловушку»: выявление при КТ или МРТ изменений, указывающих на ЦВЗ, рождает соблазн объяснить сосудистым поражением любой неврологический синдром, имеющийся у больного [3].
Безусловно, при остром развитии экстрапирамидного синдрома и обнаружении с помощью КТ или МРТ «свежего» ишемического или геморрагического очага в глубинных отделах мозга диагноз очевиден. Однако диагностическая ситуация не всегда бывает столь однозначной. Следует учитывать, что очаги, выявляющиеся при КТ/МРТ, в подкорковых структурах, зачастую бывают асимптомными [4]. Поэтому обнаружение не только клинических, но и нейровизуализационных признаков ЦВЗ (даже в области базальных ганглиев!) еще не означает, что экстрапирамидный синдром вызван именно сосудистым поражением мозга, а не иным процессом, не имеющим специфических, выявляемых КТ или МРТ маркеров (например, нейродегенеративным заболеванием или побочным действием лекарственных средств). В связи с этим диагностика любых экстрапирамидных синдромов, в т. ч. паркинсонизма сосудистого генеза, должна предусматривать доказательство причинно-следственной связи между сосудистым поражением мозга и неврологическим синдромом, невозможное без знания их клинических особенностей [5].
До сих пор в литературе сохраняется значительный разброс показателей распространенности СП, на долю которого отводится 1‒15% случаев [6‒9]. Jellinger, представивший результаты патоморфологического исследования более 2000 больных с паркинсонизмом, обнаружил, что различные варианты сосудистого поражения мозга (мультиинфарктное состояние, лейкоэнцефалопатия, лакунарные или ограниченные инфаркты в базальных ганглиях и стволе) могут быть расценены как причина паркинсонизма у 6% больных, но почти у 10% из них, наряду с сосудистыми изменениями, были выявлены умеренные признаки дегенеративного поражения мозга (увеличение численности телец Леви в черной субстанции по сравнению с контрольными лицами того же возраста), что могло указывать на сочетание ЦВЗ с БП. В связи с этим сосудистое поражение мозга было признано ведущей причиной паркинсонизма лишь у 3‒6% больных [10]. При этом сочетание тех или иных признаков ЦВЗ с тельцами Леви (т. е. с БП) наблюдалось примерно в 4 раза чаще, чем истинный СП. Более высокие цифры распространенности СП получены при исследовании групп больных в специализированных центрах. В исследовании, проведенном в Центре экстрапирамидных заболеваний, ЦВЗ оказалось причиной около 9 случаев паркинсонизма (общее число больных ‒ 254). В когорте пациентов с паркинсонизмом, представленных Mehanna и Jankovic (более 10 000 человек), на долю СП приходилось около 8%. Таким образом, СП опережал по частоте любую из мультисистемных дегенераций (но не их совокупность) [11].
С другой стороны, синдром паркинсонизма выявляется у 11% больных с ишемическими инсультами и 14% больных с «подкорковой» формой дисциркуляторной энцефалопатии, что может свидетельствовать о более широком распространении СП, особенно легких форм, чем это стало принято считать в последние годы [5, 12, 13]. Более того, отдельные паркинсонические симптомы, не позволяющие согласно общепринятым критериям диагностировать синдром паркинсонизма, выявляются у 36% больных с ишемическими инсультами, в т. ч. брадикинезия – у 45% больных с лакунарными инфарктами и 7% больных с территориальными инфарктами. Для обозначения этих симптомов, которые могут быть связаны не только с сосудистым поражением мозга, но и с ранней стадией нейродегенеративных заболеваний, возрастными изменениями подкорковых структур, по аналогии с легким (умеренным) нарушением когнитивных функций (mild cognitive impairment) предложен термин «легкие паркинсонические знаки» (mild parkinsonian signs) [14]. К последним предлагают относить случаи, когда выявляются один симптом паркинсонизма легкой или умеренной степени (оценка по соответствующей рубрике UPDRS 1 или 2 балла) либо 2 или более симптомов, оценка которых не превышает 1 балл (к этому представляется необходимым добавить наличие олигобрадикинезии не более чем в одном регионе тела: аксиальный отдел, верхние конечности, нижние конечности) [15].
Этиология и патогенез СП
Исследования последних лет подтвердили, что наиболее часто СП возникает при заболеваниях, поражающих малые мозговые артерии, кровоснабжающие глубинные отделы мозга [16, 17]. Самой распространенной причиной СП является гипертоническая микроангиопатия (артериопатия), которая морфологически характеризуется липогиалинозом мелких артерий и артериол. Распространенная патология малых артерий вызывает диффузное двустороннее ишемическое поражение белого вещества в перивентрикулярной зоне, зрительной лучистости и семиовальном центре, а также множественные лакунарные (размером до 15 мм) инфаркты в базальных ганглиях и глубинных отделах белого вещества полушарий головного мозга.Если лакунарные очаги чаще обусловлены окклюзией мелких сосудов, то в генезе диффузного поражения белого вещества ведущая роль принадлежит повторным эпизодам системной артериальной гипотензии, вызывающей гипоперфузию в концевых зонах стенозированных пенетрирующих артерий или водораздельных зонах на границах смежных сосудистых бассейнов. Особая уязвимость кровоснабжения этих зон определяется тем, что пенетрирующие артерии отходят под прямым углом от питающих их артерий на основании мозга, их тонкостью и длиной, малым количеством коллатералей, а также наступающих в результате их дегенерации дополнительной «деколлатерализацией» и патологической извитостью.
В результате хронической ишемии или, что более вероятно, повторных преходящих эпизодов умеренной ишемии глубинных слоев белого вещества полушарий головного мозга развиваются неполные инфаркты, сопровождающиеся демиелинизацией, гибелью олигодендроцитов и аксональной дисфункцией, но не формированием очагов некроза. Кроме зон неполной ишемии, диффузное поражение белого вещества может включать мелкие инфаркты и кисты, расширение периваскулярных пространств, периваскулярный отек, глиоз, отложение в периваскулярных пространствах гемосидерина (микрокровоизлияния) и другие изменения. В развитии этих изменений, помимо ишемии, важную роль может играть нарушение гематоэнцефалического барьера с проникновением белков плазмы через сосудистую стенку во время эпизодов резкого повышения артериального давления, ведущее к периваскулярному энцефалолизису. Гибель структурных элементов белого вещества при недостаточном замещении образовавшихся дефектов астроцитами в конечном итоге приводит к формированию губчатой структуры белого вещества мозга (спонгиозу) [14]. Диффузное поражение белого вещества (нейровизуализационно определяемое как лейкоареоз) выявляется при КТ и МРТ как в перивентрикулярной, так и в субкортикальной зоне.
У больных, не страдающих артериальной гипертензией, причиной диффузного поражения белого вещества могут быть так называемый «сенильный артериолосклероз», часто сочетающийся с патологической извитостью артериол, амилоидная микроангиопатия, васкулиты, микроангиопатия при системной красной волчанке, антифосфолипидный синдром, наследственные ангиопатии (например, церебральная аутосомно-доминантная артериопатия с субкортикальными инфарктами и лейкоэнцефалопатией или ангиопатия, связанная с pseudoxanthoma elasticum).
У больных с поражением крупных и средних экстра- и интракраниальных сосудов поражение глубинных отделов мозга, ведущее к развитию СП, может быть следствием гемодинамических механизмов или артерио-артериальной эмболии. При этом могут развиваться как лакунарные, так и более крупные подкорковые инфаркты. Сравнительно небольшие подкорковые инфаркты иногда возникают и в том случае, когда атеросклеротическая бляшка или эмбол в крупной мозговой артерии (например, средней мозговой артерии) частично или полностью перекрывает просвет отходящих от нее одного-двух пенетрирующих сосудов. Редкими причинами СП могут быть кровоизлияния в средний мозг (обычно связанные с разрывом артериовенозных мальформаций) и скорлупу (чаще связанные с гипертонической артериопатией и разрывом возникающих при ней микроаневризм), амилоидная ангиопатия, узелковый полиартериит и иные церебральные васкулиты.
Имеются сообщения о развитии паркинсонизма у больных с расширением периваскулярных пространств (криблюрами) в области базальных ганглиев, у которых при аутопсии не было выявлено иных морфологических изменений [18]. Криблюры имеют вид небольших округлых полостей, часто сообщающихся между собой и образующих спонгиоформную или сетчатую структуру (etat crible). Криблюры часто сопутствуют диффузному поражению мелких пенетрирующих сосудов мозга и обычно не связаны с ишемическим поражением ткани.
Клинические особенности СП
Клинические особенности СП можно разделить на три основные группы: особенности самого паркинсонического синдрома, наличие сопутствующих неврологических синдромов и особенности течения (табл. 1).
В последние годы клиника СП часто ассоциируется с «паркинсонизмом нижней части тела» (ПНЧТ). Однако данный синдром нельзя отнести к истинному синдрому паркинсонизма, поскольку у больных отсутствуют кардинальные симптомы. ПНЧТ оказался частью широкого спектра нарушений ходьбы, наблюдающихся у пожилых больных с сосудистыми или дегенеративными заболеваниями головного мозга. Нарушения ходьбы, характерные для ПНЧТ, обозначаются также как апраксия ходьбы или (что корректнее) лобная дисбазия.
Больной с ПНЧТ обычно испытывает существенные затруднения в начале движения. Он долго не может сдвинуться с места, с трудом отрывает «намагниченные» ноги от пола, делая несколько пробных скользящих мелких шажков или топчась на месте. Сдвинувшись, больной продолжает движение мелкими шаркающими шажками. Иногда этот паттерн ходьбы остается неизменным в течение всего движения (marche a petits pas), но у части больных через несколько шагов ходьба становится более уверенной, а шаг более широким.
Однако при поворотах, преодолении препятствий, когда необходимо изменить программу движения, вновь возникают те же самые трудности. Временами идущий больной внезапно застывает, не в состоянии сдвинуться с места, при этом туловище, продолжая движение, смещается вперед, что может привести к падению. В отличие от истинного паркинсонизма, несмотря на существенное уменьшение длины шага, площадь опоры при ходьбе не уменьшается, а увеличивается, а стопы располагаются под углом. При этом походка иногда напоминает походку Чарли Чаплина.
Хотя ПНЧТ напоминает некий фрагмент паркинсонизма (поскольку паркинсоноподобная симптоматика проявляется лишь во время ходьбы, а в положении лежа или сидя ее выявить не удается, данный синдром точнее было бы назвать «паркинсонизмом ходьбы»), его не следует относить к паркинсонизму, поскольку нарушения ходьбы вызваны не гипокинезией или ригидностью, признаков которых при осмотре не выявляется, а постуральными нарушениями.
Сравнительная характеристика паркинсонизма и дисбазии дана в таблице 2.
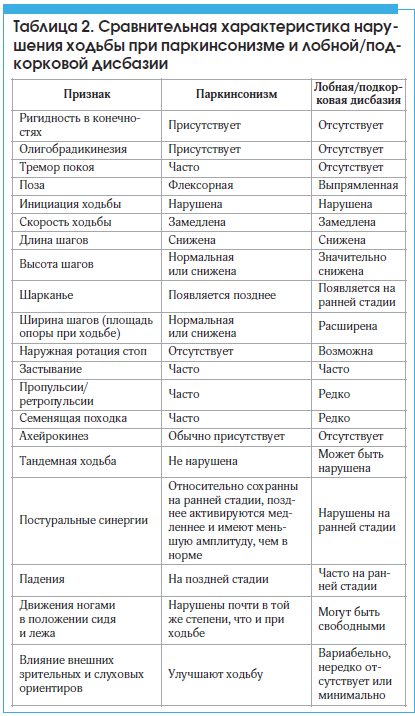
Наличие пирамидных и мозжечковых знаков обычно исключает БП, но не всегда позволяет отдифференцировать СП от других нейродегенеративных заболеваний, прежде всего относящихся к группе паркинсонизм-плюс. Так, сочетание паркинсонизма с мозжечковым и умеренным пирамидным синдромом возможно при мультисистемной атрофии, а сочетание паркинсонизма с быстро нарастающей постуральной неустойчивостью, грубым псевдобульбарным синдромом и деменцией лобного типа ‒ при прогрессирующем надъядерным параличом. Причиной же сочетания паркинсонизма с двусторонним пирамидным синдромом у пожилых людей может быть сочетание БП и спондилогенной шейной миелопатии.
Некоторые синдромы возможны при обоих состояниях, но развиваются при СП чаще и на более раннем этапе, чем при БП. К ним относятся, например, псевдобульбарный синдром или деменция. С другой стороны, такие немоторные нарушения, как галлюцинации, аносмия, нарушения поведения во сне с быстрыми движениями глаз, типичны для БП, но обычно не выявляются при СП.
Особенности течения СП
Течение СП значительно более вариабельно, чем течение БП, что отражает более высокую гетерогенность синдрома. Средний возраст больных СП выше, чем у больных БП, но может колебаться от 40 до 90 лет [19]. Причиной более позднего развития СП может быть не только повышение с возрастом заболеваемости сосудистой патологией, но и увеличение предрасположенности к развитию паркинсонизма, связанной с возрастными дегенеративными изменениями в мозге. Однако не столь редко СП встречается и в молодом возрасте, чаще всего это происходит при наличии наследственной артериопатии, васкулита или тяжелой артериальной гипертензии.Начало СП может быть острым, но чаще бывает подострым или хроническим. Иногда развитию СП предшествует один или несколько эпизодов инсультов, при этом экстрапирамидная симптоматика может развиваться в остром периоде или отсроченно ‒ спустя несколько месяцев после инсульта, иногда на фоне регресса пирамидных или мозжечковых нарушений, обладающих способностью «маскировать» паркинсонические симптомы. Описан вариант отставленного развития паркинсонизма после кровоизлияния в средний мозг, которое может указывать на роль вторичных де- или реиннервационных изменений в базальных ганглиях [20].
Последующее течение бывает непрерывно прогрессирующим, стационарным и регрессирующим. Наиболее типичны для СП 2 варианта течения: 1) острое или подострое начало с последующей стабилизацией и/или частичным регрессом симптомов; 2) прогрессирующее ступенеобразное (флуктуирующее) течение (с чередованием периодов прогрессирования, стабилизации и частичного регресса). Возможно и неуклонно прогрессирующее течение, однако в этом случае прогрессирование при СП обычно происходит быстрее, чем при БП [20‒22].
Данные нейровизуализации и клинико-нейровизуализационные корреляции
КТ и МРТ чаще всего обнаруживают изменения, связанные с преимущественным поражением церебральных мелких сосудов (табл. 3).
Морфологическим субстратом постинсультного варианта СП, обычно развивающимся в течение 6 мес. после перенесенного острого нарушения мозгового кровообращения (ОНМК), чаще всего были территориальные инфаркты в подкорковой зоне бассейна средней мозговой артерии или бассейне передней мозговой артерии. У отдельных больных отмечалось также поражение среднего мозга и таламуса. Морфологическим субстратом безынсультного варианта СП, развивающегося в рамках дисциркуляторной энцефалопатии и характеризующегося постепенным началом и прогредиентным течением, чаще всего являлись диффузное поражение глубинных отделов белого вещества полушарий и множественные лакунарные инфаркты, связанные с церебральной микроангиопатией. Проведенное нами исследование показало, что если в отношении когнитивных нарушений существует прямая зависимость между ними и обширностью лейкоареоза, то в случае паркинсонизма такая зависимость отсутствует.
Таким образом, вероятность развития и тяжесть СП в решающей степени зависят не от общего объема поражения мозговой ткани, а от локализации поражения в стратегически значимых зонах (подкорковое белое вещество, задние отделы скорлупы, чечевицеобразное ядро, черная субстанция, лобная доля, таламус). В связи с этим выделены несколько патогенетических вариантов СП. Проведенное нами сопоставление данных МРТ у 29 больных с СП и 26 больных с дисциркуляторной энцефалопатией, не имевших признаков паркинсонизма, также не выявило существенных различий в общей распространенности лейкоареоза, степени расширения желудочковой системы или общем числе лакунарных очагов, в то же время у больных с паркинсонизмом чаще выявлялись очаги в скорлупе и бледном шаре, был более выраженным лейкоареоз в проекции глубинных отделов лобных долей, отмечалось более значительное расширение передних рогов. У больных СП с асимметричной симптоматикой на стороне, контралатеральной более пораженным конечностям, как правило, выявлялись более крупные и/или многочисленные очаги в базальных ганглиях либо более распространенный лейкоареоз.
На наш взгляд, эти результаты свидетельствуют о том, что в развитии СП ключевую роль играет не столько общий объем поражения, сколько его локализация в определенных («стратегических») зонах.
Диагностика СП
Диагностика СП наталкивается на двоякого рода сложности. С одной стороны, существуют трудности в дифференциальной диагностике паркинсонизма с другими двигательными нарушениями, возникающими у больных с ЦВЗ. С другой стороны, отсутствие патогномоничных клинических признаков СП, в т. ч. возможность положительной реакции на препараты леводопы, а с другой стороны, частое наличие сосудистых изменений в подкорковых отделах мозга у пожилых затрудняют дифференциальную диагностику СП с БП и мультисистемными дегенерациями.Достоверная диагностика СП возможна лишь при патоморфологическом исследовании и требует, с одной стороны, выявления цереброваскулярного поражения, а с другой ‒ отсутствия депигментации и дегенеративных изменений с формированием телец Леви в компактной части черной субстанции, а также и признаков других нейродегенеративных изменений, тогда как клиническая диагностика СП неизбежно носит вероятностный характер. Она требует констатации:
1) синдрома паркинсонизма;
2) наличия ЦВЗ;
3) установления между ними причинно-следственной связи.
Диагностика синдрома паркинсонизма возможна при наличии не менее 2-х симптомов из числа 4-х основных: гипокинезии, ригидности, тремора покоя, постуральной неустойчивости. При этом гипокинезию (как ведущее проявление паркинсонизма, обычно определяющее тяжесть состояния больного) нередко выделяют в качестве облигатного симптома.
У больных с ЦВЗ за паркинсонизм нередко принимают другие неврологические синдромы. Например, пирамидную недостаточность, нарушающую тонкие движения в конечностях и вызывающую специфические изменения ходьбы, ошибочно расценивают как гипокинезию. Следует учитывать, что при повторении чередующихся движений кистями или стопами (например, при сведении и разведении большого и указательного пальцев кисти) в случае легкого пирамидного пареза ограничение движений имеет постоянный характер, тогда как для гипокинезии характерно затрудненное начало движения, а затем быстрое утомление со снижением амплитуды и фрагментацией движений («декремент»).
Наличие ЦВЗ подтверждается выявлением сосудистых факторов риска (в частности, артериальной гипертензии, сахарного диабета, гиперлипидемии, курения и т. д.), признаков сердечно-сосудистых заболеваний (например, ишемической болезни сердца, заболеваний сердца с высоким риском кардиогенной эмболии, облитерирующего поражения сосудов нижних конечностей и т. д.), стенозирующего поражения прецеребральных или церебральных артерий (сосудистый шум над сонными артериями при аускультации, данные УЗИ, ангиографии или МР-ангиографии), наличие в анамнезе эпизодов ОНМК. Однако решающее значение часто имеют данные КТ и МРТ, позволяющие подтвердить факт сосудистого повреждения мозга, уточнить его локализацию и распространенность.
Отсутствие сосудистых изменений в веществе мозга, по данным МРТ, практически исключает диагноз СП (данные КТ менее определенны, т. к. она не столь чувствительна, как МРТ, к лакунарным поражениям и диффузным изменениям белого вещества).
С другой стороны, наличие ЦВЗ, в т. ч. очаговых, многоочаговых или диффузных изменений в мозге, по данным МРТ/КТ, следует рассматривать как необходимое условие диагностики СП, но его нельзя считать достаточным, т. к. это еще не означает, что именно сосудистое повреждение мозга является причиной паркинсонизма.
В связи с этим диагностика СП требует не только констатации признаков паркинсонизма и ЦВЗ, но и доказательства причинно-следственной связи между ними.
Между тем опыт показывает, что диагностика СП требует комплексного подхода, который бы увязывал особенности клинических проявлений и данных инструментальных методов исследования, прежде всего нейровизуализации. В 1997 г. мы предложили клинико-нейровизуализационные критерии СП (табл. 4), которые можно использовать в клинической практике и для проведения научных исследований [21].

Сходные критерии были опубликованы международной группой исследователей в 2004 г. на основе клинико-патоморфологических сопоставлений.
Обобщая опыт диагностики СП, мы сформулировали более прагматичные критерии, пригодные для повседневной клинической практики. Для установления сосудистого генеза паркинсонизма необходимо наличие не менее 2-х из следующих 3-х критериев.
1. Атипичный характер двигательного расстройства, отличающийся от классической картины паркинсонизма при нейродегенеративных заболеваниях (например, БП) по двигательному рисунку, локализации, наличию сопутствующих синдромов и отражающий логику сосудистого, а не дегенеративного или иного процесса.
2. Характерное течение: развитие вскоре после инсульта (например, в течение 6 мес.), острое или подострое начало, длительные периоды стабилизации, возможность регресса симптомов, ступенчатое нарастание тяжести синдрома с периодами стабилизации и обратного развития симптомов.
3. Поражение «стратегических» для паркинсонизма зон, по данным КТ или МРТ.
Диагноз СП менее вероятен в следующих случаях:
• отсутствие изменений сосудистого генеза при МРТ;
• несоответствие характера и степени клинических проявлений локализации и распространенности сосудистого повреждения мозга (по данным МРТ): отсутствие поражения «стратегических» зон;
• стойкая высокая эффективность леводопы на протяжении нескольких лет;
• развитие паралича взора вниз в отсутствие паралича взора вверх;
• признаки прогрессирующей вегетативной недостаточности;
• раннее развитие зрительных галлюцинаций;
• наличие атрофии среднего мозга и скорлупы и других признаков прогрессирующего надъядерного паралича (ПНП) и множественной системной атрофии (МСА) (по данным МРТ).
Диаметр среднего мозга позволяет надежно дифференцировать СП с ПНП.
Следует отметить, что при сосудистом поражении мозга в результате разрушения связей между лобными долями, подкорковыми структурами, мозжечком и стволовыми образованиями возникает сложная констелляция двигательных нарушений, которую нелегко разложить на отдельные синдромы. Двигательный дефект у данного конкретного больного может быть следствием сочетания гипокинезии и ригидности с нарушением постуральных реакций, пирамидной недостаточностью, мозжечковой и вестибулярной атаксией и т. д. Паркинсонические симптомы часто лишь «вкраплены» в эту сложную синдромальную структуру и отнюдь не всегда определяют тяжесть состояния больного. Поэтому термин «сосудистый паркинсонизм» целесообразно использовать лишь в том случае, когда паркинсонические симптомы либо представлены изолированно, либо доминируют в клинической картине ЦВЗ, которая может напоминать клинику БП или одного из вариантов паркинсонизма-плюс.
Комбинация БП с ЦВЗ
Уже упоминалось, что у пожилых людей с БП часто выявляются сопутствующие цереброваскулярные изменения, но, в отличие от болезни Альцгеймера, они при БП встречаются примерно с той же частотой или лишь немного чаще, чем в среднем в популяции. При БП действуют факторы как повышающие, так и снижающие риск ЦВЗ. Снижают риск ЦВЗ низкая частота курения, конституциональная склонность к артериальной гипотензии, тенденция к снижению под влиянием леводопы артериального давления, липидов, глюкозы.С другой стороны, ортостатическая гипотензия (усиливается под действием противопаркинсонических препаратов), связанная с ней артериальная гипертензия в положении лежа, а также малая физическая активность, возможная гипергомоцистеинемия, вызванная леводопой, кардиальная вальвулопатия, вызванная эрголиновыми агонистами дофаминовых рецепторов, повышают риск сосудистой патологии мозга.
Ранее уже упоминалось, что методы функциональной нейровизуализации, оценивающие пресинаптические (нигростриарные) маркеры (в частности, DAT, FP-CIT, β-CIT), не позволяют четко дифференцировать БП с СП: захват изотопа у больных СП снижен по сравнению с нормой, хотя имеет особый паттерн (более диффузное симметричное снижение). Отличительные признаки СП и комбинации БП с ЦВЗ см. в таблице 5.
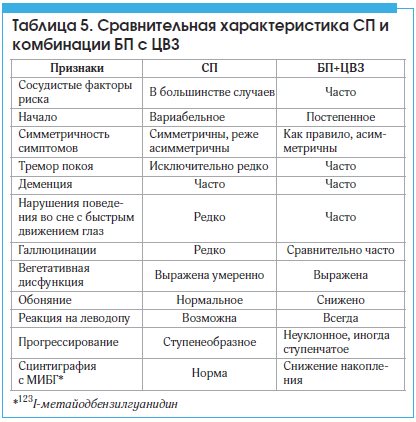
Данных, свидетельствующих о возможном участии сосудистых факторов в развитии БП, нет. Оказывают ли коморбидные сосудистые изменения существенное влияние на клиническую картину и течение заболевания, остается предметом дискуссий. Наши данные показывают, что умеренные и выраженные сосудистые изменения в мозге у больных БП способны усугублять двигательный дефект, прежде всего, за счет усиления постуральной неустойчивости. Цереброваскулярные поражения не влияют на общий уровень когнитивных нарушений (за исключением тяжелых случаев), но могут усугублять дизрегуляторный когнитивный дефицит. Тем не менее можно полагать, что раннее выявление и лечение ЦВЗ у пациента с БП предположительно способно оказать благоприятное влияние на течение заболевания.
Особенно трудна диагностика СП с атипичным (паркинсоническим) вариантом прогрессирующего надъядерного паралича и паркинсоническим вариантом мультисистемной атрофии, а также деменции с тельцами Леви. В силу этого СП следует рассматривать как диагноз исключения.
Лечение СП
Исходя из общеклинических соображений, можно выделить два основных направления в лечении СП: базисную терапию, направленную на предупреждение дальнейшего повреждения мозга, и симптоматическую терапию, направленную на коррекцию паркинсонизма и сопутствующих проявлений. Базисная терапия должна включать коррекцию основных сосудистых факторов риска и проводиться с учетом ведущего механизма повреждения мозга (микроангиопатия, церебральный атеросклероз, кардиоэмболия).Ключевое значение имеет контроль артериальной гипертензии. C целью профилактики повторных ишемических эпизодов показано длительное применение антиагрегантов (аспирина 50‒100 мг/сут, иногда в сочетании с дипиридамолом 200‒400 мг/сут или клопидогрела 75 мг/сут). При опасности кардиогенной эмболии или неэффективности антиагрегантов назначают непрямые антикоагулянты.
Симптоматическая терапия заключается прежде всего в применении противопаркинсонических препаратов. У больных с СП можно испробовать весь арсенал противопаркинсонических средств: препараты леводопы, агонисты дофаминовых рецепторов, амантадин, ингибиторы моноаминоксидазы (МАО) В.
Однако препаратами первого выбора являются препараты леводопы. Пробная терапия леводопой предусматривает постепенное увеличение дозы до 1000–1500 мг/сут. Общая длительность пробной терапии не должна быть менее 3-х месяцев.
При назначении иных противопаркинсонических средств следует учитывать возможность их побочного действия на когнитивные функции и состояние сердечно-сосудистой системы.
Возможности стереотаксических вмешательств при СП систематически не изучены. Между тем у некоторых больных с ограниченным поражением базальных ганглиев они могут быть эффективными. Goto et al. (1997) представили случай успешной двусторонней задневентральной паллидотомии у больной с двусторонним поражением скорлупы и наружного сегмента бледного шара, которая привела к частичному регрессу акинетико-ригидного синдрома [23]. Однако, как показывает опыт стереотаксических вмешательств при мультисистемных дегенерациях, при экстранигральных формах паркинсонизма (не связанных с поражением черной субстанции) и тем более при мультифокальном поражении мозга разработанные к настоящему времени стереотаксические операции чаще оказываются неэффективными.
Литература
1. Critchley M. Arteriosclerotic parkinsonism // Brain. 1929. Vol. 52. P.23–83.
2. Vizcarra J.A., Lang A.E., Sethi K.D., Espay A.J. Vascular Parkinsonism: deconstructing a syndrome // Mov Disord. 2015. Vol. 30(7). P.886–894.
3. Яхно Н.Н., Дамулин И.В., Гончаров О.А. Сравнительная оценка различных форм паркинсонизма у больных пожилого и старческого возраста // Журн. невролог. и психиатр. им. С.С. Корсакова. 1992. Т.92. №1. С.67–72 [Jahno N.N., Damulin I.V., Goncharov O.A. Sravnitel'naja ocenka razlichnyh form parkinsonizma u bol'nyh pozhilogo i starcheskogo vozrasta // Zhurn. nevrolog. i psihiatr. im. S.S. Korsakova. 1992. T.92. №1. S.67–72 (in Russian)].
4. Bhatia K.P., Marsden C.D. The behavioural and motor consequences of focal lesions of the basal ganglia in man // Brain. 1994. Vol. 117. P.859–876.
5. Левин О.С. Экстрапирамидные синдромы при цереброваскулярных заболеваниях. Диагностика и лечение экстрапирамидных расстройств / под ред. В.Н. Штока., И.А. Ивановой-Смоленской, О.С. Левина. М.: Медпресс-информ. 2003. С.503–519 [Levin O.S. Jekstrapiramidnye sindromy pri cerebrovaskuljarnyh zabolevanijah. Diagnostika i lechenie jekstrapiramidnyh rasstrojstv / рod red. V.N. Shtoka., I.A. Ivanovoj-Smolenskoj, O.S. Levina. M.: Medpress-inform. 2003. S.503–519 (in Russian)].
6. Голубев В.Л., Левин Я.И., Вейн А.М. Болезнь Паркинсона и синдром паркинсонизма. М.: МЕДпресс. 1999. 415 с. [Golubev V.L., Levin Ja.I., Vejn A.M. Bolezn' Parkinsona i sindrom parkinsonizma. M.: MEDpress. 1999. 415 s. (in Russian)].
7. Жученко Т.Д., Вейн А.М., Голубев В.Л. и др. Сосудистый паркинсонизм // Журн. невропат. и психиатр. им. С.С. Корсакова. 1998. Т. 98. С.62–65 [Zhuchenko T.D., Vejn A.M., Golubev V.L., i dr. Sosudistyj parkinsonizm // Zhurn. nevropat. i psihiatr. im. S.S. Korsakova. 1998. T. 98. S.62–65 (in Russian)].
8. Inzelberg R., Bornstein N.M., Reider I., Korczyn A.D. Basal ganglia lacunes and parkinsonism // Neuroepidemiology. 1994. Vol. 13. P.108–112.
9. Thajeb P. Gait disorders of multi-infarct dementia. CT and clinical correlation // Acta Neurol. Scand. 1993. Vol. 87. P.239–242.
10. Jellinger K.A. Vascular parkinsonism // Therapy. 2008. Vol. 5(2). P.237–255.
11. Mehanna R., Jankovic J. Movement disorders in cerebrovascular disease. www.thelancet.com neurology Published online. 2013 http://dx.doi.org/10.1016/S1474-4422(13)70057-77.
12. Van Zagten M., Lodder J., Kessels F. Gait disorder and parkinsonian signs in patients with stroke related to small deep infarcts and white matter lesions // Mov. disord. 1998. Vol. 13. P.89–95.
13. Левин О.С. Клинико-нейропсихологические и нейровизуализационные аспекты дифференциальной диагностики паркинсонизма: автореф. дис. … д-ра. мед. наук. М., 2003. 36 с. [Levin O.S. Kliniko-nejropsihologicheskie i nejrovizualizacionnye aspekty differencial'noj diagnostiki parkinsonizma: аvtoref. dis. … d-ra med. nauk. M. 2003. 36 s. (in Russian)].
14. Верещагин Н.В., Моргунов В.А., Гулевская Т.С. Патология головного мозга при атеросклерозе и артериальной гипертонии. М.: Медицина. 1997. 287 с. [Vereshhagin N.V., Morgunov V.A., Gulevskaja T.S. Patologija golovnogo mozga pri ateroskleroze i arterial'noj gipertonii. M.: Medicina. 1997. 287 s. (in Russian)].
15. Louis E.D., Bennett D.A. Mild Parkinsonian signs: An overview of an emerging concept // Mov. Disord. 2007. Vol. 22. P.1681–1688.
16. Жученко Т.Д., Вейн А.М., Голубев В.Л. и др. Сосудистый паркинсонизм // Журн. невропат. и психиатр. им. С.С. Корсакова. 1998. Т. 98. С.62–65 [Zhuchenko T.D., Vejn A.M., Golubev V.L., i dr. Sosudistyj parkinsonizm // Zhurn. nevropat. i psihiatr. im. S.S. Korsakova. 1998. T. 98. S.62–65 (in Russian)].
17. FitzGerald P.M., Jankovic J. Lower body parkinsonism: evidence for vascular etiology // Mov.Disord. 1989. Vol. 4. P.249–260.
18. Fenelon G., Gray F., Wallays C. et al. Parkinsonism and dilatation of the perivascular spaces (etat crible) of the striatum // Mov. Disord. 1995. Vol. 10. P.754–760.
19. Winikates J., Jankovic J. Clinical correlates of vascular parkinsonism // Arch. Neurol. 1999. Vol. 56. P.98–102.
20. Ghika J., Bogousslavsky J. Abnormal movements // In: J.Bogousslavsky, L. Caplan (eds) Stroke syndromes. Cambridge University Press. 1996. P.91–101.
21. Левин О.С. Сосудистый паркинсонизм // Неврологический журнал. 1997. №4. C.42–51 [Levin O.S. Sosudistyj parkinsonizm // Nevrologicheskij zhurnal. 1997. №4. S.42–51 (in Russian)].
22. Winikates J., Jankovic J. Vascular progressive supranuclear palsy // J. Neural. Transm. 1994. Vol. 42. P.189–201.
23. Goto S., Kunitoku N., Soyama N. et al. Posteroventral pallidotomy in a patients with parkinsonism caused by hypoxic encephalopathy // Neurology. 1997. Vol. 49. P.707–710.
2. Vizcarra J.A., Lang A.E., Sethi K.D., Espay A.J. Vascular Parkinsonism: deconstructing a syndrome // Mov Disord. 2015. Vol. 30(7). P.886–894.
3. Яхно Н.Н., Дамулин И.В., Гончаров О.А. Сравнительная оценка различных форм паркинсонизма у больных пожилого и старческого возраста // Журн. невролог. и психиатр. им. С.С. Корсакова. 1992. Т.92. №1. С.67–72 [Jahno N.N., Damulin I.V., Goncharov O.A. Sravnitel'naja ocenka razlichnyh form parkinsonizma u bol'nyh pozhilogo i starcheskogo vozrasta // Zhurn. nevrolog. i psihiatr. im. S.S. Korsakova. 1992. T.92. №1. S.67–72 (in Russian)].
4. Bhatia K.P., Marsden C.D. The behavioural and motor consequences of focal lesions of the basal ganglia in man // Brain. 1994. Vol. 117. P.859–876.
5. Левин О.С. Экстрапирамидные синдромы при цереброваскулярных заболеваниях. Диагностика и лечение экстрапирамидных расстройств / под ред. В.Н. Штока., И.А. Ивановой-Смоленской, О.С. Левина. М.: Медпресс-информ. 2003. С.503–519 [Levin O.S. Jekstrapiramidnye sindromy pri cerebrovaskuljarnyh zabolevanijah. Diagnostika i lechenie jekstrapiramidnyh rasstrojstv / рod red. V.N. Shtoka., I.A. Ivanovoj-Smolenskoj, O.S. Levina. M.: Medpress-inform. 2003. S.503–519 (in Russian)].
6. Голубев В.Л., Левин Я.И., Вейн А.М. Болезнь Паркинсона и синдром паркинсонизма. М.: МЕДпресс. 1999. 415 с. [Golubev V.L., Levin Ja.I., Vejn A.M. Bolezn' Parkinsona i sindrom parkinsonizma. M.: MEDpress. 1999. 415 s. (in Russian)].
7. Жученко Т.Д., Вейн А.М., Голубев В.Л. и др. Сосудистый паркинсонизм // Журн. невропат. и психиатр. им. С.С. Корсакова. 1998. Т. 98. С.62–65 [Zhuchenko T.D., Vejn A.M., Golubev V.L., i dr. Sosudistyj parkinsonizm // Zhurn. nevropat. i psihiatr. im. S.S. Korsakova. 1998. T. 98. S.62–65 (in Russian)].
8. Inzelberg R., Bornstein N.M., Reider I., Korczyn A.D. Basal ganglia lacunes and parkinsonism // Neuroepidemiology. 1994. Vol. 13. P.108–112.
9. Thajeb P. Gait disorders of multi-infarct dementia. CT and clinical correlation // Acta Neurol. Scand. 1993. Vol. 87. P.239–242.
10. Jellinger K.A. Vascular parkinsonism // Therapy. 2008. Vol. 5(2). P.237–255.
11. Mehanna R., Jankovic J. Movement disorders in cerebrovascular disease. www.thelancet.com neurology Published online. 2013 http://dx.doi.org/10.1016/S1474-4422(13)70057-77.
12. Van Zagten M., Lodder J., Kessels F. Gait disorder and parkinsonian signs in patients with stroke related to small deep infarcts and white matter lesions // Mov. disord. 1998. Vol. 13. P.89–95.
13. Левин О.С. Клинико-нейропсихологические и нейровизуализационные аспекты дифференциальной диагностики паркинсонизма: автореф. дис. … д-ра. мед. наук. М., 2003. 36 с. [Levin O.S. Kliniko-nejropsihologicheskie i nejrovizualizacionnye aspekty differencial'noj diagnostiki parkinsonizma: аvtoref. dis. … d-ra med. nauk. M. 2003. 36 s. (in Russian)].
14. Верещагин Н.В., Моргунов В.А., Гулевская Т.С. Патология головного мозга при атеросклерозе и артериальной гипертонии. М.: Медицина. 1997. 287 с. [Vereshhagin N.V., Morgunov V.A., Gulevskaja T.S. Patologija golovnogo mozga pri ateroskleroze i arterial'noj gipertonii. M.: Medicina. 1997. 287 s. (in Russian)].
15. Louis E.D., Bennett D.A. Mild Parkinsonian signs: An overview of an emerging concept // Mov. Disord. 2007. Vol. 22. P.1681–1688.
16. Жученко Т.Д., Вейн А.М., Голубев В.Л. и др. Сосудистый паркинсонизм // Журн. невропат. и психиатр. им. С.С. Корсакова. 1998. Т. 98. С.62–65 [Zhuchenko T.D., Vejn A.M., Golubev V.L., i dr. Sosudistyj parkinsonizm // Zhurn. nevropat. i psihiatr. im. S.S. Korsakova. 1998. T. 98. S.62–65 (in Russian)].
17. FitzGerald P.M., Jankovic J. Lower body parkinsonism: evidence for vascular etiology // Mov.Disord. 1989. Vol. 4. P.249–260.
18. Fenelon G., Gray F., Wallays C. et al. Parkinsonism and dilatation of the perivascular spaces (etat crible) of the striatum // Mov. Disord. 1995. Vol. 10. P.754–760.
19. Winikates J., Jankovic J. Clinical correlates of vascular parkinsonism // Arch. Neurol. 1999. Vol. 56. P.98–102.
20. Ghika J., Bogousslavsky J. Abnormal movements // In: J.Bogousslavsky, L. Caplan (eds) Stroke syndromes. Cambridge University Press. 1996. P.91–101.
21. Левин О.С. Сосудистый паркинсонизм // Неврологический журнал. 1997. №4. C.42–51 [Levin O.S. Sosudistyj parkinsonizm // Nevrologicheskij zhurnal. 1997. №4. S.42–51 (in Russian)].
22. Winikates J., Jankovic J. Vascular progressive supranuclear palsy // J. Neural. Transm. 1994. Vol. 42. P.189–201.
23. Goto S., Kunitoku N., Soyama N. et al. Posteroventral pallidotomy in a patients with parkinsonism caused by hypoxic encephalopathy // Neurology. 1997. Vol. 49. P.707–710.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
