Применение препарата Пантогам актив (D-, L-гопантеновая кислота) в терапии когнитивных и тревожных расстройств у пациентов с артериальной гипертензией (реферат)
РМЖ. №1(II) от 27.03.2018 стр. 89-94
Рубрика:
Кардиология
Цель исследования: оценка эффективности и безопасности терапии D-, L-гопантеновой кислотой (Пантогам актив) когнитивных и тревожных нарушений у пациентов с артериальной гипертензией (АГ).
Материал и методы:
в исследовании приняли участие 80 пациентов кардиологического стационара с верифицированным диагнозом АГ и коморбидными когнитивными и тревожными нарушениями; 50 пациентов составили основную группу, 30 пациентов — группу контроля. Все пациенты получали стандартную гипотензивную терапию. В комплексную терапию пациентов основной группы был включен Пантогам актив в суточной дозе от 600 до 1200 мг. Проводилось психопатологическое и психометрическое обследование с сопоставлением полученных данных с динамикой соматических показателей (электрокардиограмма, суточное мониторирование артериального давления, биохимический анализ крови). Длительность терапии D-, L-гопантеновой кислотой составила 28 дней.
Результаты исследования: получены данные о достоверной редукции как когнитивных, так и тревожных нарушений в основной группе по сравнению с контрольной, а также у пациентов, перенесших острое нарушение мозгового кровообращения в анамнезе. Положительная динамика наблюдалась на протяжении всего времени лечения.
Заключение: подтверждена возможность использования D-, L-гопантеновой кислоты (Пантогам актив) в качестве препарата выбора с бимодальной ноотропной и транквилизирующей активностью для лечения когнитивных и тревожных нарушений у пациентов с АГ. Показано, что в процессе терапии Пантогамом актив происходит быстрая (в течение 1-й нед. терапии) и достоверная редукция тревожных и когнитивных нарушений.
Ключевые слова: соматопсихиатрия, когнитивные нарушения, тревожные расстройства, артериальная гипертензия, лечение.
Для цитирования: Применение препарата Пантогам актив (D-, L-гопантеновая кислота) в терапии когнитивных и тревожных расстройств у пациентов с артериальной гипертензией (реферат). РМЖ. Медицинское обозрение. 2018;26(1(II)):89-94.
Материал и методы:
в исследовании приняли участие 80 пациентов кардиологического стационара с верифицированным диагнозом АГ и коморбидными когнитивными и тревожными нарушениями; 50 пациентов составили основную группу, 30 пациентов — группу контроля. Все пациенты получали стандартную гипотензивную терапию. В комплексную терапию пациентов основной группы был включен Пантогам актив в суточной дозе от 600 до 1200 мг. Проводилось психопатологическое и психометрическое обследование с сопоставлением полученных данных с динамикой соматических показателей (электрокардиограмма, суточное мониторирование артериального давления, биохимический анализ крови). Длительность терапии D-, L-гопантеновой кислотой составила 28 дней.
Результаты исследования: получены данные о достоверной редукции как когнитивных, так и тревожных нарушений в основной группе по сравнению с контрольной, а также у пациентов, перенесших острое нарушение мозгового кровообращения в анамнезе. Положительная динамика наблюдалась на протяжении всего времени лечения.
Заключение: подтверждена возможность использования D-, L-гопантеновой кислоты (Пантогам актив) в качестве препарата выбора с бимодальной ноотропной и транквилизирующей активностью для лечения когнитивных и тревожных нарушений у пациентов с АГ. Показано, что в процессе терапии Пантогамом актив происходит быстрая (в течение 1-й нед. терапии) и достоверная редукция тревожных и когнитивных нарушений.
Ключевые слова: соматопсихиатрия, когнитивные нарушения, тревожные расстройства, артериальная гипертензия, лечение.
Для цитирования: Применение препарата Пантогам актив (D-, L-гопантеновая кислота) в терапии когнитивных и тревожных расстройств у пациентов с артериальной гипертензией (реферат). РМЖ. Медицинское обозрение. 2018;26(1(II)):89-94.
Pantogam activ (D-, L-hopantenic acid) in the treatment of cognitive and anxiety disorders in patients with arterial hypertension (summary)
Aim: to evaluate the efficacy and safety of the use of D-, L- hopantenic acid (Pantogam active) in the treatment of cognitive and anxiety disorders in patients with arterial hypertension.
Patients and Methods: the study enrolled 80 patients of the cardiology department with the verified diagnosis of hypertension and comorbid cognitive and anxiety disorders (50 patients in the main group, 30 patients in the control group). All patients received standard antihypertensive therapy. Complex therapy of the patients of the main group included Pantogam active in a daily dose from 600 to 1200 mg. Psychopathological and psychometric examinations were conducted, the data were compared with the dynamics of physical parameters (ECG, 24-hour blood pressure monitoring, biochemical blood test). The duration of therapy with D-, L-gepantenic acid was 28 days
Results: there was a significant reduction in both cognitive and anxiety disorders in the main group compared with the control group and in patients with a prior stroke. The positive dynamics was observed during the treatment period.
Conclusions: authors support the possibility of using D-, L-hopantenic acid (Pantogam active) as a drug of choice with bimodal activity (nootropic and tranquilizing) in the treatment of cognitive and anxiety disorders in patients with arterial hypertension. It is shown that the therapy with Pantogam active provides a fast (during the first week of therapy) and reliable reduction of cognitive and anxiety disorders.
A rapid (in the first week) significant reduction of cognitive and anxiety disorders during the treatment with Pantogam activ was noted.
Key words: somatopsychiatry, cognitive impairment, anxiety disorders, arterial hipertension, treatment.
For citation: Pantogam activ (D-, L-hopantenic acid) in the treatment of cognitive and anxiety disorders in patients with arterial hypertension (summary) // RMJ. 2018. № 1(II). P. 89–94.
Aim: to evaluate the efficacy and safety of the use of D-, L- hopantenic acid (Pantogam active) in the treatment of cognitive and anxiety disorders in patients with arterial hypertension.
Patients and Methods: the study enrolled 80 patients of the cardiology department with the verified diagnosis of hypertension and comorbid cognitive and anxiety disorders (50 patients in the main group, 30 patients in the control group). All patients received standard antihypertensive therapy. Complex therapy of the patients of the main group included Pantogam active in a daily dose from 600 to 1200 mg. Psychopathological and psychometric examinations were conducted, the data were compared with the dynamics of physical parameters (ECG, 24-hour blood pressure monitoring, biochemical blood test). The duration of therapy with D-, L-gepantenic acid was 28 days
Results: there was a significant reduction in both cognitive and anxiety disorders in the main group compared with the control group and in patients with a prior stroke. The positive dynamics was observed during the treatment period.
Conclusions: authors support the possibility of using D-, L-hopantenic acid (Pantogam active) as a drug of choice with bimodal activity (nootropic and tranquilizing) in the treatment of cognitive and anxiety disorders in patients with arterial hypertension. It is shown that the therapy with Pantogam active provides a fast (during the first week of therapy) and reliable reduction of cognitive and anxiety disorders.
A rapid (in the first week) significant reduction of cognitive and anxiety disorders during the treatment with Pantogam activ was noted.
Key words: somatopsychiatry, cognitive impairment, anxiety disorders, arterial hipertension, treatment.
For citation: Pantogam activ (D-, L-hopantenic acid) in the treatment of cognitive and anxiety disorders in patients with arterial hypertension (summary) // RMJ. 2018. № 1(II). P. 89–94.
В статье подтверждена возможность использования D-, L-гопантеновой кислоты (Пантогам актив) в качестве препарата выбора для лечения когнитивных и тревожных нарушений у пациентов с АГ. Показано, что в процессе терапии Пантогамом актив происходит быстрая и достоверная редукция тревожных и когнитивных нарушений.
Введение
Когнитивные и тревожные расстройства при артериальной гипертензии (АГ) широко распространены [1–4]. Частота когнитивных нарушений (КН) при АГ превышает таковую в популяции в 10 раз [5]. Субклинические проявления поражения головного мозга наблюдаются по меньшей мере у 44% пациентов с АГ [6]. По данным отечественных исследований [7], нелеченная в течение 5 лет АГ приводит к возникновению КН у 68% пациентов. Таким образом, АГ рассматривается в настоящее время как самый значимый фактор риска развития не только острых нарушений мозгового кровообращения (ОНМК) [8], но и синдрома умеренных КН [9, 10]. Прогрессирование АГ способствует нарастанию проявлений КН [14, 15] посредством нарушений структуры сосудистой стенки, что ведет к увеличению очагов разрежения белого вещества и появлению лакун в головном мозге (феномен «немых» лакун по данным магнитно-резонансной томографии) [16–18].Актуальность изучения КН, не достигающих степени сосудистой деменции, обусловлена также тем, что их своевременное выявление и адекватное лечение у пациентов с АГ повышают качество жизни больных, позволяя замедлить, а в некоторых случаях и предотвратить наступление тяжелых проявлений когнитивных расстройств (деменции) [19].
Особого внимания заслуживает вопрос о КН у пациентов, перенесших ОНМК / транзиторную ишемическую атаку (ТИА). Согласно данным ряда исследований [20, 21], частота развития недементных КН в постинсультном периоде достигает 40–49%. Умеренные КН в постинсультном периоде приводят к социально-бытовой дезадаптации даже в отсутствие значительных двигательных нарушений [22]. Существует также тесная корреляция между КН и прогнозом степени инвалидизации пациентов. Среди больных с постинсультной деменцией также выше риск повторного инсульта, что отчасти связано с трудностями проведения вторичной профилактики сосудистой патологии у этой категории пациентов. По некоторым данным, восстановление двигательных функций у больных с более выраженными КН протекает медленнее и обычно бывает менее значительным [23, 24].
Наличие тревожных расстройств имеет высокое прогностическое значение для пациентов с АГ [25]. Частота тревожных нарушений при АГ, по данным литературы [26–28], достигает 42%, что вдвое превышает их распространенность в популяции (без АГ).
В большинстве исследований констатируется факт негативного влияния коморбидных тревожных расстройств на течение АГ (неконтролируемая гипертензия, повышение риска развития кардиоваскулярных осложнений) и поведение пациентов (нарушение комплаентности и формирование кардиоперсонифицированных синдромов) [29–31]. Кроме того, тревожные нарушения, амплифицирующие симптом соматической патологии, способствуют ухудшению показателей качества жизни пациентов, усложнению и удорожанию процесса лечения. Так, по данным ряда авторов [32, 33], наличие тревожных расстройств у пациентов кардиологического стационара повышает риск кардиальных осложнений в 2,5–4,9 раза. Тревожные расстройства также коррелируют с увеличением медицинских затрат и длительностью пребывания больного в кардиологическом отделении [34].
Таким образом, тревожные и когнитивные расстройства лидируют по частоте у пациентов с АГ и серьезным образом влияют на течение и прогноз кардиоваскулярной патологии, ухудшают приверженность терапии и снижают качество жизни больных. Необходимость проведения адекватной купирующей и профилактической терапии этих расстройств наряду с лечением основного заболевания не вызывает сомнений.
Современная гипотензивная терапия способствует реализации протективного эффекта при острых сосудистых катастрофах (инсульт), но не обладает профилактическим действием в отношении умеренных когнитивных и тревожных нарушений [35, 36]. Назначаемые кардиологами и терапевтами ноотропные препараты для коррекции КН нередко способствуют повышению уровня тревоги. В свою очередь анксиолитическая терапия (в комбинации с кардиотропными препаратами) значительно улучшает качество жизни больных АГ, однако имеет ряд ограничений. Так, пациенты часто избегают приема противотревожных препаратов (бензодиазепины), опасаясь развития привыкания, поведенческих побочных эффектов (вялость, заторможенность, нарушения внимания, трудности сосредоточения) [37]. С учетом отмеченных проблем в последние годы все чаще возникает потребность в препаратах со сбалансированным транквилизирующим и ноотропным эффектом [38, 39].
Назначение одного препарата, обладающего бимодальной (анксиолитической и ноотропной) активностью, способствует одновременной коррекции как когнитивных, так и тревожных расстройств. Таким препаратом является Пантогам актив (группировочное название D-, L-гопантеновая кислота, активное вещество — рац-гопантеновая кислота). За счет включения в формулу L-изомера Пантогам актив обладает дополнительным анксиолитическим действием и может применяться длительно без развития привыкания, синдрома отмены или гиперстимуляции у пациентов с сердечно-сосудистыми заболеваниями [40].
Цель исследования — оценка эффективности и безопасности терапии препаратом Пантогам актив когнитивных и/или тревожных нарушений у пациентов с длительно текущей АГ II–III степени.
Материал и методы
Открытое контролируемое рандомизированное исследование проведено на базе клиники кардиологии Университетской клинической больницы № 1 Первого Московского государственного медицинского университета им. И.М. Сеченова. Наблюдали 80 пациентов, находившихся на стационарном лечении с диагнозом АГ и коморбидными когнитивными (легкими и умеренными) и тревожными нарушениями.Критерии включения: мужчины и женщины в возрасте от 18 до 75 лет, находящиеся на стационарном лечении с подтвержденным диагнозом АГ II–III стадии; легкие и умеренные когнитивные (<26 баллов по Монреальской шкале оценки когнитивных функций (MoCA)) и тревожные расстройства (>30 баллов по шкале самооценки тревоги Шихана); добровольное информированное согласие пациента на участие в исследовании.
Критерии исключения: гиперчувствительность к Пантогаму актив в анамнезе; наличие психической патологии, депрессивный эпизод умеренной или тяжелой степени, рекуррентная депрессия, текущий эпизод умеренной или тяжелой степени, злоупотребление анальгетиками, стероидами или гормонами, зависимость от психоактивных веществ, расстройства влечений, наличие суицидальных намерений, наличие соматической патологии: тяжелой печеночной и/или почечной недостаточности, злокачественных новообразований, глаукомы; соматическое заболевание в стадии декомпенсации, не позволяющее провести адекватную клиническую и психометрическую оценку психического состояния пациента.
Методом стратификационной рандомизации из пациентов, получавших стандартную гипотензивную терапию, были сформированы 2 группы. В основную группу вошли 50 пациентов, в комплексную терапию которых был включен Пантогам актив. В контрольную группу вошли 30 пациентов. Группы были сопоставимы по полу, возрасту, проявлениям АГ и психических расстройств. Средний возраст пациентов составил 62,2±6,1 года в основной группе и 58,6±5,4 года в группе контроля. В обеих группах преобладали пациенты женского пола (62,8% — в основной и 65,1% — в контрольной).
Суточная доза Пантогама актив варьировала от 600 до 1200 мг в зависимости от клинических проявлений и выраженности когнитивных и тревожных расстройств. Длительность терапии составила 28 дней. Состояние пациентов оценивалось до начала терапии, через 7, 14 и 28 дней лечения (1–4-й визиты).
Исследование проводилось врачом-психиатром совместно с кардиологом в условиях кардиологического стационара и на последующем постстационарном этапе. Терапевтическая эффективность Пантогама актив анализировалась по шкалам оценки когнитивных расстройств МоСА, самооценки тревоги Шихана, самооценки качества жизни EQ-5D.
Безопасность и переносимость препарата оценивались на основании данных клинических и параклинических соматических исследований (биохимический анализ крови, электрокардиограмма (ЭКГ), показатели артериального давления (АД), частоты сердечных сокращений (ЧСС), масса тела, суточное мониторирование АД).
Статистический анализ количественных данных проводили с помощью лицензионного статистического пакета SPSS 13.0 for Windows. Динамика состояния пациентов изучалась при помощи теста Вилкоксона. Уровень значимости принимался p≤0,05.
Результаты исследования
В процессе терапии Пантогамом актив ни один пациент не был исключен из исследования. На протяжении всего стационарного и постстационарного этапов терапии пациенты, принимавшие Пантогам актив, демонстрировали высокую приверженность лечению. Пантогам актив назначался в стартовой дозе 600 мг/сут. В соответствии с выраженностью клинических проявлений тревожных нарушений и КН 20 (40%) пациентов принимали Пантогам актив в суточной дозе 600 мг на протяжении всего курса терапии; у 15 (30%) потребовалось увеличение дозы до 900 мг после 1-й нед. терапии; еще в 15 (30%) случаях (пациенты с ОНМК/ТИА в анамнезе) доза была увеличена по усмотрению исследователя до 1200 мг/сут после 2-й нед. терапии. Средняя суточная доза Пантогама актив в изученной выборке составила 900 мг/сут.Средняя длительность АГ составила 17,9±9,2 года. В 68% наблюдений диагностирована II cтадия АГ, в 32% — III стадия; очень высокий риск сердечно-сосудистых осложнений выявлен в 73% наблюдений. Средние баллы
по шкале МоСА на момент начала и окончания терапии были следующими: на начало исследования (1-й день) в основной группе — 21,5±3,1 балла, на конец исследования (28-й день) — 27,5±1,2 балла, в контрольной группе эти показатели были соответственно 21,7±4,3 и 23,6±2,5 балла. Обращает на себя внимание более выраженное увеличение
балльной оценки в основной группе по сравнению с контрольной к моменту окончания терапии.
Когнитивные нарушения
У всех пациентов имелись нарушения памяти, в большинстве наблюдений — расстройства оптико-пространственной деятельности, абстрактного мышления и внимания.В основной группе были выделены пациенты, перенесшие ОНМК/ТИА, — 18 человек. В контрольной группе также были выделены пациенты с ОНМК/ТИА в анамнезе – 10 человек. Средняя длительность постинсультного периода составила 6,07±4,08 года в основной группе и 6,5±3,9 года в контрольной группе. Преобладающим типом перенесенного ОНМК был ишемический инсульт — 16 (88,8%) наблюдений в основной группе,
9 (90%) — в контрольной.
На рисунке 1 представлена сравнительная характеристика выраженности КН в основной и контрольной группах, а также у пациентов обеих групп с ОНМК/ТИА в анамнезе. Практически по всем дименсиям КН оценки по шкале MoCA пациентов с ОНМК/ТИА в анамнезе были достоверно ниже (р≤0,05) таковых в основной и контрольной группах. Динамика некоторых показателей шкалы MoCA в процессе терапии отражена на рисунке 1.
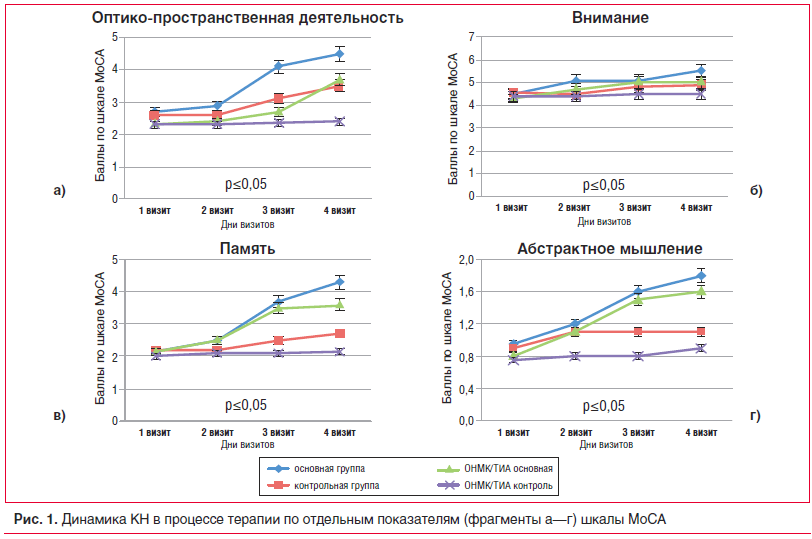
Улучшение по показателю оптико-пространственной деятельности происходило как в основной, так и в контрольной группе, однако при терапии Пантогамом актив положительная динамика была более выражена, а показатели на момент окончания лечения у пациентов, перенесших ОНМК/ТИА в анамнезе, достоверно превышали таковые у больных контрольной группы (p<0,05). Восстановление когнитивных функций в основной группе происходило достаточно равномерно, с 1-й нед. терапии Пантогамом актив, как и в дальнейшем — уже после выписки из стационара. Такая равномерная устойчивая пролонгированная активность в отношении коррекции КН свидетельствует о выраженном положительном эффекте длительного приема Пантогама актив.
Нарушения внимания и мнестических функций также подверглись редукции, при этом имелось достоверное различие показателей контрольной группы и пациентов с ОНМК/ТИА к концу терапии (рис. 1). На рисунке 1 представлена также динамика показателей абстрактного мышления в процессе терапии.
Динамика КН по остальным разделам МоСА (называние, речь, ориентировка) была не столь очевидной, возможно, отчасти и из-за изначальной незначительной выраженности их проявлений.
Тревожные нарушения
Тревожные расстройства в подавляющем числе наблюдений (90%) были представлены нозогенными реакциями (тревожно-фобические и тревожно-диссоциативные по типу «прекрасного равнодушия»). В единичных случаях (по 5% наблюдений) были диагностированы паническое расстройство и генерализованное тревожное расстройство.Для тревожно-фобических реакций (50% наблюдений) были характерны ипохондрические страхи и опасения по поводу своего здоровья и возможности социальной реабилитации. Среди соматических (в т. ч. конверсионных) проявлений тревоги преобладали усиленное сердцебиение или ощущение перебоев в работе сердца, неприятные ощущения или боли в груди кардионевротического характера, колебания АД, предобморочные состояния, приливы жара или холода, потливость, ощущение «кома» в горле или чувство нехватки воздуха, одышка, неравномерность дыхания.
Вторыми по распространенности (40% случаев) были тревожно-диссоциативные реакции (по типу «прекрасного равнодушия»). Для данной группы пациентов были характерны демонстративно-пренебрежительное отношение к лечению, прогнозу и исходу заболевания, нарочитое отрицание беспокойства по поводу гипертонии (возникновение подъемов АД связывалось не с каким-либо патологическим процессом, а со случайными, преходящими явлениями: ситуативным стрессом, переутомлением). Однако за фасадом наигранного оптимизма выявлялся страх, связанный с нарушением сердечной деятельности, а также наблюдались проявления соматизированной тревоги (тахикардия, ощущение внутренней дрожи, потливость, нарушения сна, неотвязные мысли о сердечной патологии).
Для пациентов, перенесших ОНМК/ТИА, были характерны именно тревожно-диссоциативные реакции — 11 (61,1%) пациентов с ОНМК/ТИА в основной группе и 7 (70%) больных в контрольной группе. В единичных наблюдениях тревожные расстройства принимали форму панических атак с витальным страхом и соматовегетативными симптомами или генерализованного тревожного расстройства. Следует отметить, что данные расстройства, как правило, манифестировали вне связи с АГ и не соотносились с особенностями течения кардиальной патологии. Структура выявленных тревожных нарушений при АГ была следующей: тревожно-фобические реакции — 50%, тревожно-диссоциативные — 40%, паническое расстройство — 5%, генерализованное расстройство — 5%. Средние значения по шкале самооценки тревоги Шихана в основной группе на момент включения в исследование составили 46,9±11,1 балла, в контрольной — 48±9,1 балла, что соответствует критериям клинически выраженной тревоги.
В основной группе у перенесших ОНМК/ТИА больных средний балл составил 42,3±10,9, в группе контроля у пациентов с ОНМК/ТИА — 42,5±11,1. Редукция тревожной симптоматики по опроснику самооценки тревоги Шихана в основной группе произошла в 100% наблюдений, при этом доля респондеров составила 88% (44 случая), частичных респондеров — 12% (6 случаев). Динамика тревожных нарушений в процессе терапии приведена на рисунке 2.
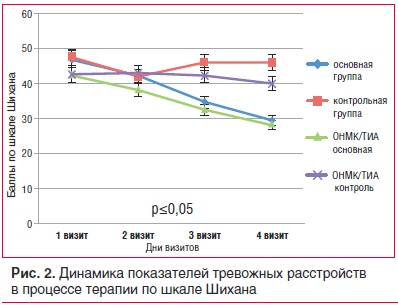
Сумма баллов по шкале самооценки тревоги Шихана снижалась уже начиная с 1-й нед. терапии при каждом последующем визите по сравнению с предыдущим. По мере продолжения терапии отмечалась достоверная редукция как нейровегетативных, соматических, так и психических симптомов тревоги (р≤0,05). Редукция тревожной симптоматики происходила при всех выявленных типах тревожных проявлений, однако наиболее выраженная и быстрая динамика отмечалась у пациентов с тревожно-фобическими нозогенными реакциями. У пациентов с тревожно-диссоциативными реакциями также происходила выраженная редукция соматовегетативной тревожной симптоматики. Достоверные различия в выраженности тревожных расстройств получены также у пациентов с ОНМК/ТИА в анамнезе. У пациентов с диагностированным паническим расстройством и генерализованным тревожным расстройством также наблюдалось облегчение состояния, но редукция панических атак за время терапии Пантогамом актив не возникала.
В контрольной группе зарегистрировано новое (хотя и незначительное) повышение показателя тревоги после 2-й нед., что может быть связано с выпиской из стационара и страхом возобновления нестабильности АД. В то же время в основной группе и у пациентов с ОНМК/ТИА в анамнезе, принимавших Пантогам актив, наблюдалась положительная и устойчивая динамика редукции тревожных проявлений, возникшая достаточно быстро — в течение 1-й нед. терапии, которая сохранялась впоследствии. Пациенты основной группы с изначально высоким уровнем тревоги (более 60 баллов по шкале Шихана) субъективно отмечали существенное снижение тревожных симптомов уже на 2–3-и сут приема Пантогама актив, что способствовало как стабилизации показателей АД, так и ускорению и упрощению подбора основной — гипотензивной терапии.
Качество жизни
Средние значения по опроснику самооценки качества жизни EQ-5D составили 54,7±14,2 балла в основной группе, 46,1±14,06 балла в подгруппе перенесших ОНМК/ТИА и 53,5±15,5 балла в контрольной группе.У пациентов, принимавших Пантогам актив, имело место достоверное улучшение показателей (р≤0,05), что субъективно связывалось больными с редукцией тревожных расстройств и улучшением способности к повседневной деятельности. Если в основной и контрольной группах в целом нарушения были не столь выражены, то достоверные различия (р≤0,05) между началом и концом терапии были выявлены у пациентов, перенесших ОНМК/ТИА, в основной группе.
Было также установлено, что прием Пантогама актив приводит у больных, перенесших ОНМК/ТИА, не только к редукции инсомнии, но и к повышению повседневной активности и энергичности.
Переносимость и безопасность Пантогама актив
Прием Пантогама актив не оказывал негативного влияния на соматическое состояние пациентов (табл. 1).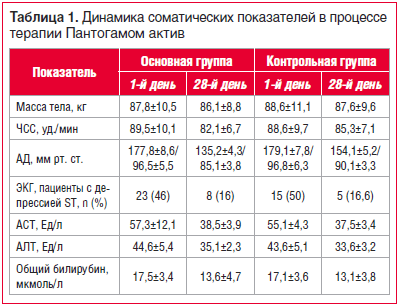
Кроме того, по некоторым параметрам (АД, ЧСС) отмечены выраженное улучшение и стабилизация показателей соматического статуса. Так, у пациентов с кризовым течением АГ основной группы за все время наблюдения и терапии Пантогамом актив кризы не возникали, в то время как 4 из 13 (30,7%) пациентов из контрольной группы перенесли по 1 гипертоническому кризу, что потребовало дополнительной коррекции гипотензивной терапии.
Нежелательные транзиторные и не требующие отмены препарата явления в виде легкой сонливости после 1-й нед. терапии (доза Пантогама актив 600 мг) были отмечены у 2 (4%) пациентов. В 2 наблюдениях были зарегистрированы трудности засыпания в течение первых 3 дней терапии (доза Пантогама актив 900 мг).
Заключение
Применение Пантогама актив приводило к достоверной редукции тревожных проявлений после 1-й нед. терапии в 100% наблюдений, при этом субъективное улучшение самочувствия пациенты отмечали уже после 2–3 дней его приема.На фоне приема Пантогама актив происходило улучшение по всем показателям шкалы МоСА. К моменту завершения исследования по шкале когнитивных расстройств МоСА доля респондеров по установленным в исследовании критериям составила 78%. Обращает на себя внимание также быстрая (в течение 1-й нед.) достоверная редукция симптомов КН у пациентов с ОНМК/ТИА в анамнезе по сравнению с контрольной группой.
Показатели качества жизни пациентов на фоне приема Пантогама актив также достоверно улучшались на протяжении всего лечения, начиная с 1-й нед. терапии. Особенно выраженное улучшение происходило у пациентов с ОНМК/ТИА в анамнезе.
Было установлено, что Пантогам актив обладает хорошим профилем переносимости и безопасности у пациентов с АГ как среднего, так и пожилого возраста (старше 65 лет), что находило свое отражение в высокой приверженности больных терапии на протяжении всего периода наблюдения. Об этом свидетельствует и желание больных продолжать лечение — об этом сообщили 46 (92%) пациентов.
Ни один пациент не выбыл из исследования. Нежелательные явления отмечались чрезвычайно редко.
Прием Пантогама актив не приводил к ухудшению соматических показателей (по данным ЭКГ, биохимического анализа крови, суточного мониторирования АД). На фоне его приема наблюдалась стабилизация показателей АД, что облегчало процесс подбора гипотензивной терапии и в некоторых случаях способствовало назначению меньшего числа препаратов. Важным моментом было отсутствие подъемов АД после выписки из стационара у пациентов, принимавших Пантогам актив, в то время как у 30% больных, получавших стандартную гипотензивную терапию, в течение 2 нед. после выписки подъем АД отмечался хотя бы 1 раз.
Полученные результаты свидетельствуют об эффективности и хорошей переносимости Пантогама актив при когнитивных и тревожных расстройствах, наблюдаемых в кардиологической практике (у пациентов с АГ). Данные исследования подтверждают возможность использования Пантогама актив в качестве препарата с бимодальной ноотранквилизирующей активностью для лечения когнитивных и тревожных нарушений. В процессе терапии Пантогамом актив происходит быстрая (в течение 1-й нед. терапии) и достоверная редукция тревожных и когнитивных проявлений.
Таким образом, терапия Пантогамом актив у пациентов с АГ и коморбидными когнитивными и тревожными расстройствами способствует (вместе с базисной кардиотропной терапией) улучшению динамических показателей кардиоваскулярной патологии.
Реферат подготовлен редакцией «РМЖ» по материалам статьи: А.Б. Смулевич, Б.А. Волель, Е.C. Терновая, Ю.М. Никитина. Применение препарата Пантогам актив (D-, L-гопантеновая кислота) в терапии когнитивных и тревожных расстройств у пациентов с артериальной гипертензией // Журнал неврологии и психиатрии им. С.С. Корсакова. 2015. № 12. С. 40–49. www.mediasphera.ru.
Литература
1. Kessler R.S., Wittchen H.U. Patterns And Correlates Of Generalized Anxiety Disorder In Community Samples // J Clin Psychiatry. 2002. Vol. 63(8). P. 4–10.
2. Kapfhammer H.P. The Relationship Between Depression, Anxiety And Heart Disease — A Psychosomatic Challenge // Psychiatr Danub. 2011. Vol. 23(4). P. 412–424.
3. Краснов В.Н., Довженко Т.В., Бобров А.Е. Тревожно-депрессивные расстройства у пациентов первичной медицинской сети // Медицинский вестник. 2010. № 11. С. 516 [Krasnov V.N., Dovzhenko T.V., Bobrov A.E. Trevozhno-depressivnye rasstrojstva u pacientov pervichnoj medicinskoj seti // Medicinskij vestnik. 2010. № 11. S. 516 (in Russian)].
4. Андрющенко А.В. Психические и психосоматические расстройства в учреждениях общесоматической сети (клинико-эпидемиологические аспекты, психосоматические соотношения, терапия): Автореф. дис. ... докт. мед. наук. М., 2011 (электронный ресурс). http://www.psychiatry.ru/cond/0/diss/2011/186 (дата обращения 22.09.2015) [Andrjushhenko A.V. Psihicheskie i psihosomaticheskie rasstrojstva v uchrezhdenijah obshhesomaticheskoj seti (kliniko-jepidemiologicheskie aspekty, psihosomaticheskie sootnoshenija, terapija): Avtoref. dis. ... dokt. med. nauk. M., 2011 (jelektronnyj resurs). http://www.psychiatry.ru/cond/0/diss/2011/186 (data obrashhenija 22.09.2015) (in Russian)].
5. Petersen R., Smith G., Waring S. et al. Mild Cognitive Impairment. Arch Neurol. 1999. Vol. 56(3). P. 303. doi:10.1001/archneur.56.3.303.
6. Kearney-Schwartz A., Rossignol P., Bracard S. et al. Vascular Structure and Function Is Correlated to Cognitive Performance and White Matter Hyperintensities in Older Hypertensive Patients With Subjective Memory Complaints // Stroke. 2009. Vol. 40(4). P. 1229–1236. doi:10.1161/strokeaha.108.532853.
7. Еремина О.В. Когнитивные нарушения у больных артериальной гипертонией (частота, диагностика, лечение): Автореф. дис. ... канд. мед. наук. Иркутск, 2007 (электронный ресурс). http://www.dissercat.com/content/kognitivnye-narusheniya-u-bolnykh-arterialnoi-gipertoniei-chastota-diagnostika-lechenie (дата обращения 22.09.2015) [Eremina O.V. Kognitivnye narushenija u bol’nyh arterial’noj gipertoniej (chastota, diagnostika, lechenie): Avtoref. dis. ... kand. med. nauk. Irkutsk, 2007 (jelektronnyj resurs). http://www.dissercat.com/content/ kognitivnye-narusheniya-u-bolnykh-arterialnoi-gipertoniei-chastota- diagnostika-lechenie (data obrashhenija 22.09.2015) (in Russian)].
8. Heart.org. www.heart.org. 2015. Available at: http://www.heart.org. Accessed 22.09.2015.
9. Reitz C., Tang M., Manly J. et al. Hypertension and the Risk of Mild Cognitive Impairment // Arch Neurol. 2007. Vol. 64(12). P. 1734. doi:10.1001/archneur.64.12.1734.
10. Sierra C., Doménech M., Camafort M., Coca A. Hypertension and Mild Cognitive Impairment // Curr Hypertens Rep. 2012. Vol. 14(6). P. 548-555. doi:10.1007/s11906-012-0315-2.
11. Grundman M. Mild Cognitive Impairment Can Be Distinguished from Alzheimer’s Disease and Normal Aging for Clinical Trials // Arch Neurol. 2004. Vol. 61(1). P. 59. doi: 10.1001/archneur.61.1.59.
12. Obisesan T. Hypertension and Cognitive Function // Clinics in Geriatric Medicine. 2009. Vol. 25(2). P. 259-288. doi:10.1016/j.cger.2009.03.002.
13. Остроумова О.А. Когнитивные нарушения при артериальной гипертонии и возможности их коррекции // Врач. 2011. № 14. С. 7–12 [Ostroumova O.A. Kognitivnye narushenija pri arterial’noj gipertonii i vozmozhnosti ih korrekcii. Vrach. 2011. № 14. S. 7–12 (in Russian)].
14. Reitz C., Tang M., Miller J. et al. Plasma Homocysteine and Risk of Mild Cognitive Impairment // Dementia and Geriatric Cognitive Disorders. 2009. Vol. 27(1). P. 11–17. doi:10.1159/000182421.
15. Морозова Т.Е., Рыкова С.М. Сердечно-сосудистые заболевания и когнитивные нарушения // Consilium Medicum. 2010. № 9. С. 85–89 [Morozova T.E., Rykova S.M. Serdechno-sosudistye zabolevanija i kognitivnye narushenija // Consilium Medicum. 2010. № 9. S. 85–89 (in Russian)].
16. Fisher C. Lacunar strokes and infarcts: A review // Neurology. 1982. Vol. 32(8). P. 871. doi:10.1212/wnl.32.8.871.
17. Bracco L., Campani D., Baratti E. et al. Relation between MRI features and dementia in cerebrovascular disease patients with leukoaraiosis: A longitudinal study // Journal of the Neurological Sciences. 1993. Vol. 120(2). P. 131–136. doi:10.1016/0022-510x(93)90263-x.
18. Mancia G., Laurent S., Agabiti-Rosei E. et al. Reappraisal of European guidelines on hypertension management: a European Society of Hypertension Task Force document // Journal of Hypertension. 2009. Vol. 27(11). P. 2121–2158. doi:10.1097/hjh.0b013e328333146d.
19. Повереннова И.Е., Севастьянова Е.В. Особенности когнитивных нарушений при артериальной гипертензии // Саратовский научно-медицинский журнал. 2008. № 4(1). С. 89–92 [Poverennova I.E., Sevast’janova E.V. Osobennosti kognitivnyh narushenij pri arterial’noj gipertenzii // Saratovskij nauchno-medicinskij zhurnal. 2008. № 4(1). S. 89–92 (in Russian)].
20. Madureira S., Guerreiro M., Ferro J. Dementia and cognitive impairment three months after stroke // Eur J Neurol. 2001. Vol. 8(6). P. 621–627. doi:10.1046/j.1468-1331.2001.00332.x.
21. Tham W., Auchus A.P., Thong M. et al. Progression of cognitive impairment after stroke: one year results from a longitudinal study of Singaporean stroke patients // J Neurol Sci. 2002. Vol. 203(4). P. 49–52.
22. Путилина М.В. Нейропротекторная терапия хронической ишемии мозга // Врач. 2008. № 8. С. 27–29 [Putilina M.V. Nejroprotektornaja terapija hronicheskoj ishemii mozga // Vrach. 2008. № 8. S. 27–29 (in Russian)].
23. Левин О.С., Усольцева Н.И., Юнищенко Н.А. Постинсультные когнитивные нарушения // Трудный пациент. 2007. № 8. С. 26–29 [Levin O.S., Usol’ceva N.I., Junishhenko N.A. Postinsul’tnye kognitivnye narushenija. Trudnyj pacient. 2007. № 8. S. 26–29 (in Russian)].
24. Левин О.С. Диагностика и лечение деменции в клинической практике. М.: Медпресс-информ, 2009 [Levin O.S. Diagnostika i lechenie demencii v klinicheskoj praktike. M.: Medpress-inform, 2009 (in Russian)].
25. Player M., Peterson L. Anxiety Disorders, Hypertension, and Cardiovascular Risk: A Review // The International Journal of Psychiatry in Medicine. 2011. Vol. 41(4). P. 365–377. doi:10.2190/pm.41.4.f.
26. Kubzansky L.D., Kawachi I. Going to the heart of the matter: do negative emotions cause coronary heart disease? // J Psychosomatic Research. 2000. Vol. 48. P. 323–337. doi:10.1016/S0022-3999(99)00091-4.
27. Johansen A., Holmen J., Stewart R., Bjerkeset O. Anxiety and depression symptoms in arterial hypertension: the influence of antihypertensive treatment. The HUNT study, Norway // Eur J Epidemiol. 2011. Vol. 27(1). P. 63–72. doi:10.1007/s10654-011-9641-y.
28. Штарик С.Ю., Петрова М.М., Гарганеева Н.П. Некоторые аспекты коморбидности тревожно-депрессивных расстройств и артериальной гипертензии // Сибирский медицинский журнал. 2009. № 24(4). С. 46–48 [Shtarik S.Ju., Petrova M.M., Garganeeva N.P. Nekotorye aspekty komorbidnosti trevozhno-depressivnyh rasstrojstv i arterial’noj gipertenzii // Sibirskij medicinskij zhurnal. 2009. № 24(4). S. 46–48 (in Russian)].
29. Волель Б.А., Терновая Е.С., Ермушева А.А., Сыркина Е.А., Ардзинба И.Б. Расстройство личности и сердечно-сосудистые заболевания (на модели артериальной гипертонии и ишемической болезни сердца) // Психические расстройства в общей медицине. 2014. № 1. С. 4–13 [Volel’ B.A., Ternovaja E.S., Ermusheva A.A., Syrkina E.A., Ardzinba I.B. Rasstrojstvo lichnosti i serdechno-sosudistye zabolevanija (na modeli arterial’noj gipertonii i ishemicheskoj bolezni serdca) // Psihicheskie rasstrojstva v obshhej medicine. 2014. № 1. S. 4–13 (in Russian)].
30. Hocaoglu C., Yeloglu C.H., Polat S. Cardiac Diseases and Anxiety Disorders. INTECH Open Access Publisher, 2011.
31. Kong D., Gao H., Lu Y. et al. Anxiety disorders are associated with increased plasma adrenomedullin level and left ventricular hypertrophy in patients with hypertension // Clinical and Experimental Hypertension. 2013. Vol. 36(1). P. 27–31. doi:10.3109/10641963.2013.783049.
32. Todaro J., Shen B., Raffa S. et al. Prevalence of anxiety disorders in men and women with established coronary heart disease // Journal of Cardiopulmonary Rehabilitation and Prevention. 2007. Vol. 27(2). P. 86–91. doi:10.1097/01.hcr.0000265036.24157.e7.
33. Vogelzangs N., Seldenrijk A., Beekman A. et al. Cardiovascular disease in persons with depressive and anxiety disorders // Journal of Affective Disorders. 2010. Vol. 125(1-3). P. 241–248. doi:10.1016/j.jad.2010.02.112.
34. Von Wachter M., Jünger S., Renz D. et al. Psychosocial stress and utilization of medical services after coronary bypass operation // Gesundheitswesen. 2000. Vol. 62(8/9). P. 451–456. doi: 10.1055/s-2000-12614.
35. O’Brien J. Cerebrovascular Disease, Cognitive Impairment, and Dementia. London: Martin Dunitz, 2004.
36. Bacon S., Campbell T., Arsenault A., Lavoie K. The Impact of Mood and Anxiety Disorders on Incident Hypertension at One Year // International Journal of Hypertension. 2014. Vol. 2014. P. 1–7. doi:10.1155/2014/953094.
37. Никольская И.Н., Гусева И.А., Близнецов Е.В., Третьякова Т.В. Роль тревожных расстройств при гипертонической болезни и возможности их коррекции // Лечащий врач. 2007. № 3. С. 89–91 [Nikol’skaja I.N., Guseva I.A., Bliznecov E.V., Tret’jakova T.V. Rol’ trevozhnyh rasstrojstv pri gipertonicheskoj bolezni i vozmozhnosti ih korrekcii // Lechashhij vrach. 2007. № 3. S. 89–91 (in Russian)].
38. Федотова А.В., Миронова О.П., Карпов Ф.А., Федин А.И. Комплексная коррекция артериальной гипертензии и когнитивных нарушений у больных с гипертонической энцефалопатией. Результаты многоцентрового исследования «ЛЕГЕНДА» // Атмосфера. Нервные болезни. 2009. № 4. С. 1–5 [Fedotova A.V., Mironova O.P., Karpov F.A., Fedin A.I. Kompleksnaja korrekcija arterial’noj gipertenzii i kognitivnyh narushenij u bol’nyh s gipertonicheskoj jencefalopatiej. Rezul’taty mnogocentrovogo issledovanija «LEGENDA» // Atmosfera. Nervnye bolezni. 2009. № 4. S. 1–5 (in Russian)].
39. Захаров В.В., Вахнина Н.В. Инсульт и когнитивные нарушения. Неврология, нейропсихиатрия, психосоматика. 2011. № 2. С. 8–14 [Zaharov V.V., Vahnina N.V. Insul’t i kognitivnye narushenija. Nevrologija, nejropsihiatrija, psihosomatika. 2011. № 2. S. 8–14 (in Russian)].
40. Дума С.Н. Оценка клинической эффективности нейропротекторов, влияющих на систему гамма-аминомасляной кислоты, при лечении когнитивных расстройств у пациентов с дисциркуляторной энцефалопатией I—II стадий // Фарматека. 2010. № 15. С. 96–100 [Duma S.N. Ocenka klinicheskoj jeffektivnosti nejroprotektorov, vlijajushhih na sistemu gamma-aminomasljanoj kisloty, pri lechenii kognitivnyh rasstrojstv u pacientov s discirkuljatornoj jencefalopatiej I—II stadij // Farmateka. 2010. № 15. S. 96–100 (in Russian)].
2. Kapfhammer H.P. The Relationship Between Depression, Anxiety And Heart Disease — A Psychosomatic Challenge // Psychiatr Danub. 2011. Vol. 23(4). P. 412–424.
3. Краснов В.Н., Довженко Т.В., Бобров А.Е. Тревожно-депрессивные расстройства у пациентов первичной медицинской сети // Медицинский вестник. 2010. № 11. С. 516 [Krasnov V.N., Dovzhenko T.V., Bobrov A.E. Trevozhno-depressivnye rasstrojstva u pacientov pervichnoj medicinskoj seti // Medicinskij vestnik. 2010. № 11. S. 516 (in Russian)].
4. Андрющенко А.В. Психические и психосоматические расстройства в учреждениях общесоматической сети (клинико-эпидемиологические аспекты, психосоматические соотношения, терапия): Автореф. дис. ... докт. мед. наук. М., 2011 (электронный ресурс). http://www.psychiatry.ru/cond/0/diss/2011/186 (дата обращения 22.09.2015) [Andrjushhenko A.V. Psihicheskie i psihosomaticheskie rasstrojstva v uchrezhdenijah obshhesomaticheskoj seti (kliniko-jepidemiologicheskie aspekty, psihosomaticheskie sootnoshenija, terapija): Avtoref. dis. ... dokt. med. nauk. M., 2011 (jelektronnyj resurs). http://www.psychiatry.ru/cond/0/diss/2011/186 (data obrashhenija 22.09.2015) (in Russian)].
5. Petersen R., Smith G., Waring S. et al. Mild Cognitive Impairment. Arch Neurol. 1999. Vol. 56(3). P. 303. doi:10.1001/archneur.56.3.303.
6. Kearney-Schwartz A., Rossignol P., Bracard S. et al. Vascular Structure and Function Is Correlated to Cognitive Performance and White Matter Hyperintensities in Older Hypertensive Patients With Subjective Memory Complaints // Stroke. 2009. Vol. 40(4). P. 1229–1236. doi:10.1161/strokeaha.108.532853.
7. Еремина О.В. Когнитивные нарушения у больных артериальной гипертонией (частота, диагностика, лечение): Автореф. дис. ... канд. мед. наук. Иркутск, 2007 (электронный ресурс). http://www.dissercat.com/content/kognitivnye-narusheniya-u-bolnykh-arterialnoi-gipertoniei-chastota-diagnostika-lechenie (дата обращения 22.09.2015) [Eremina O.V. Kognitivnye narushenija u bol’nyh arterial’noj gipertoniej (chastota, diagnostika, lechenie): Avtoref. dis. ... kand. med. nauk. Irkutsk, 2007 (jelektronnyj resurs). http://www.dissercat.com/content/ kognitivnye-narusheniya-u-bolnykh-arterialnoi-gipertoniei-chastota- diagnostika-lechenie (data obrashhenija 22.09.2015) (in Russian)].
8. Heart.org. www.heart.org. 2015. Available at: http://www.heart.org. Accessed 22.09.2015.
9. Reitz C., Tang M., Manly J. et al. Hypertension and the Risk of Mild Cognitive Impairment // Arch Neurol. 2007. Vol. 64(12). P. 1734. doi:10.1001/archneur.64.12.1734.
10. Sierra C., Doménech M., Camafort M., Coca A. Hypertension and Mild Cognitive Impairment // Curr Hypertens Rep. 2012. Vol. 14(6). P. 548-555. doi:10.1007/s11906-012-0315-2.
11. Grundman M. Mild Cognitive Impairment Can Be Distinguished from Alzheimer’s Disease and Normal Aging for Clinical Trials // Arch Neurol. 2004. Vol. 61(1). P. 59. doi: 10.1001/archneur.61.1.59.
12. Obisesan T. Hypertension and Cognitive Function // Clinics in Geriatric Medicine. 2009. Vol. 25(2). P. 259-288. doi:10.1016/j.cger.2009.03.002.
13. Остроумова О.А. Когнитивные нарушения при артериальной гипертонии и возможности их коррекции // Врач. 2011. № 14. С. 7–12 [Ostroumova O.A. Kognitivnye narushenija pri arterial’noj gipertonii i vozmozhnosti ih korrekcii. Vrach. 2011. № 14. S. 7–12 (in Russian)].
14. Reitz C., Tang M., Miller J. et al. Plasma Homocysteine and Risk of Mild Cognitive Impairment // Dementia and Geriatric Cognitive Disorders. 2009. Vol. 27(1). P. 11–17. doi:10.1159/000182421.
15. Морозова Т.Е., Рыкова С.М. Сердечно-сосудистые заболевания и когнитивные нарушения // Consilium Medicum. 2010. № 9. С. 85–89 [Morozova T.E., Rykova S.M. Serdechno-sosudistye zabolevanija i kognitivnye narushenija // Consilium Medicum. 2010. № 9. S. 85–89 (in Russian)].
16. Fisher C. Lacunar strokes and infarcts: A review // Neurology. 1982. Vol. 32(8). P. 871. doi:10.1212/wnl.32.8.871.
17. Bracco L., Campani D., Baratti E. et al. Relation between MRI features and dementia in cerebrovascular disease patients with leukoaraiosis: A longitudinal study // Journal of the Neurological Sciences. 1993. Vol. 120(2). P. 131–136. doi:10.1016/0022-510x(93)90263-x.
18. Mancia G., Laurent S., Agabiti-Rosei E. et al. Reappraisal of European guidelines on hypertension management: a European Society of Hypertension Task Force document // Journal of Hypertension. 2009. Vol. 27(11). P. 2121–2158. doi:10.1097/hjh.0b013e328333146d.
19. Повереннова И.Е., Севастьянова Е.В. Особенности когнитивных нарушений при артериальной гипертензии // Саратовский научно-медицинский журнал. 2008. № 4(1). С. 89–92 [Poverennova I.E., Sevast’janova E.V. Osobennosti kognitivnyh narushenij pri arterial’noj gipertenzii // Saratovskij nauchno-medicinskij zhurnal. 2008. № 4(1). S. 89–92 (in Russian)].
20. Madureira S., Guerreiro M., Ferro J. Dementia and cognitive impairment three months after stroke // Eur J Neurol. 2001. Vol. 8(6). P. 621–627. doi:10.1046/j.1468-1331.2001.00332.x.
21. Tham W., Auchus A.P., Thong M. et al. Progression of cognitive impairment after stroke: one year results from a longitudinal study of Singaporean stroke patients // J Neurol Sci. 2002. Vol. 203(4). P. 49–52.
22. Путилина М.В. Нейропротекторная терапия хронической ишемии мозга // Врач. 2008. № 8. С. 27–29 [Putilina M.V. Nejroprotektornaja terapija hronicheskoj ishemii mozga // Vrach. 2008. № 8. S. 27–29 (in Russian)].
23. Левин О.С., Усольцева Н.И., Юнищенко Н.А. Постинсультные когнитивные нарушения // Трудный пациент. 2007. № 8. С. 26–29 [Levin O.S., Usol’ceva N.I., Junishhenko N.A. Postinsul’tnye kognitivnye narushenija. Trudnyj pacient. 2007. № 8. S. 26–29 (in Russian)].
24. Левин О.С. Диагностика и лечение деменции в клинической практике. М.: Медпресс-информ, 2009 [Levin O.S. Diagnostika i lechenie demencii v klinicheskoj praktike. M.: Medpress-inform, 2009 (in Russian)].
25. Player M., Peterson L. Anxiety Disorders, Hypertension, and Cardiovascular Risk: A Review // The International Journal of Psychiatry in Medicine. 2011. Vol. 41(4). P. 365–377. doi:10.2190/pm.41.4.f.
26. Kubzansky L.D., Kawachi I. Going to the heart of the matter: do negative emotions cause coronary heart disease? // J Psychosomatic Research. 2000. Vol. 48. P. 323–337. doi:10.1016/S0022-3999(99)00091-4.
27. Johansen A., Holmen J., Stewart R., Bjerkeset O. Anxiety and depression symptoms in arterial hypertension: the influence of antihypertensive treatment. The HUNT study, Norway // Eur J Epidemiol. 2011. Vol. 27(1). P. 63–72. doi:10.1007/s10654-011-9641-y.
28. Штарик С.Ю., Петрова М.М., Гарганеева Н.П. Некоторые аспекты коморбидности тревожно-депрессивных расстройств и артериальной гипертензии // Сибирский медицинский журнал. 2009. № 24(4). С. 46–48 [Shtarik S.Ju., Petrova M.M., Garganeeva N.P. Nekotorye aspekty komorbidnosti trevozhno-depressivnyh rasstrojstv i arterial’noj gipertenzii // Sibirskij medicinskij zhurnal. 2009. № 24(4). S. 46–48 (in Russian)].
29. Волель Б.А., Терновая Е.С., Ермушева А.А., Сыркина Е.А., Ардзинба И.Б. Расстройство личности и сердечно-сосудистые заболевания (на модели артериальной гипертонии и ишемической болезни сердца) // Психические расстройства в общей медицине. 2014. № 1. С. 4–13 [Volel’ B.A., Ternovaja E.S., Ermusheva A.A., Syrkina E.A., Ardzinba I.B. Rasstrojstvo lichnosti i serdechno-sosudistye zabolevanija (na modeli arterial’noj gipertonii i ishemicheskoj bolezni serdca) // Psihicheskie rasstrojstva v obshhej medicine. 2014. № 1. S. 4–13 (in Russian)].
30. Hocaoglu C., Yeloglu C.H., Polat S. Cardiac Diseases and Anxiety Disorders. INTECH Open Access Publisher, 2011.
31. Kong D., Gao H., Lu Y. et al. Anxiety disorders are associated with increased plasma adrenomedullin level and left ventricular hypertrophy in patients with hypertension // Clinical and Experimental Hypertension. 2013. Vol. 36(1). P. 27–31. doi:10.3109/10641963.2013.783049.
32. Todaro J., Shen B., Raffa S. et al. Prevalence of anxiety disorders in men and women with established coronary heart disease // Journal of Cardiopulmonary Rehabilitation and Prevention. 2007. Vol. 27(2). P. 86–91. doi:10.1097/01.hcr.0000265036.24157.e7.
33. Vogelzangs N., Seldenrijk A., Beekman A. et al. Cardiovascular disease in persons with depressive and anxiety disorders // Journal of Affective Disorders. 2010. Vol. 125(1-3). P. 241–248. doi:10.1016/j.jad.2010.02.112.
34. Von Wachter M., Jünger S., Renz D. et al. Psychosocial stress and utilization of medical services after coronary bypass operation // Gesundheitswesen. 2000. Vol. 62(8/9). P. 451–456. doi: 10.1055/s-2000-12614.
35. O’Brien J. Cerebrovascular Disease, Cognitive Impairment, and Dementia. London: Martin Dunitz, 2004.
36. Bacon S., Campbell T., Arsenault A., Lavoie K. The Impact of Mood and Anxiety Disorders on Incident Hypertension at One Year // International Journal of Hypertension. 2014. Vol. 2014. P. 1–7. doi:10.1155/2014/953094.
37. Никольская И.Н., Гусева И.А., Близнецов Е.В., Третьякова Т.В. Роль тревожных расстройств при гипертонической болезни и возможности их коррекции // Лечащий врач. 2007. № 3. С. 89–91 [Nikol’skaja I.N., Guseva I.A., Bliznecov E.V., Tret’jakova T.V. Rol’ trevozhnyh rasstrojstv pri gipertonicheskoj bolezni i vozmozhnosti ih korrekcii // Lechashhij vrach. 2007. № 3. S. 89–91 (in Russian)].
38. Федотова А.В., Миронова О.П., Карпов Ф.А., Федин А.И. Комплексная коррекция артериальной гипертензии и когнитивных нарушений у больных с гипертонической энцефалопатией. Результаты многоцентрового исследования «ЛЕГЕНДА» // Атмосфера. Нервные болезни. 2009. № 4. С. 1–5 [Fedotova A.V., Mironova O.P., Karpov F.A., Fedin A.I. Kompleksnaja korrekcija arterial’noj gipertenzii i kognitivnyh narushenij u bol’nyh s gipertonicheskoj jencefalopatiej. Rezul’taty mnogocentrovogo issledovanija «LEGENDA» // Atmosfera. Nervnye bolezni. 2009. № 4. S. 1–5 (in Russian)].
39. Захаров В.В., Вахнина Н.В. Инсульт и когнитивные нарушения. Неврология, нейропсихиатрия, психосоматика. 2011. № 2. С. 8–14 [Zaharov V.V., Vahnina N.V. Insul’t i kognitivnye narushenija. Nevrologija, nejropsihiatrija, psihosomatika. 2011. № 2. S. 8–14 (in Russian)].
40. Дума С.Н. Оценка клинической эффективности нейропротекторов, влияющих на систему гамма-аминомасляной кислоты, при лечении когнитивных расстройств у пациентов с дисциркуляторной энцефалопатией I—II стадий // Фарматека. 2010. № 15. С. 96–100 [Duma S.N. Ocenka klinicheskoj jeffektivnosti nejroprotektorov, vlijajushhih na sistemu gamma-aminomasljanoj kisloty, pri lechenii kognitivnyh rasstrojstv u pacientov s discirkuljatornoj jencefalopatiej I—II stadij // Farmateka. 2010. № 15. S. 96–100 (in Russian)].

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
