Железодефицитная анемия беременных: профилактика и лечение
РМЖ. Мать и дитя. №2(I) от 28.02.2018 стр. 59-64
Рубрика:
Гинекология
Акушерство
Железодефицитная анемия (ЖДА) — одно из самых распространенных заболеваний в мире. Анемия беременных более чем в 90% случаев является железодефицитной, при этом частота выявления ЖДА зависит от уровня социально-
экономического развития региона. В статье подробно рассматриваются стадии развития дефицита железа, влияние анемии на развитие плода, диагностика, профилактика и лечение ЖДА у беременных. Лечение рассматривается как с позиций диетотерапии, так и с позиций медикаментозного лечения. Патогенетическими методами лечения ЖДА являются ферротерапия (пероральная и внутривенная), эритропоэзстимулирующие препараты в сочетании с ферротерапией и гемотрансфузии. Для лечения анемии и восполнения запасов железа в основном применяются пероральные препараты железа. Рассматриваются и сравниваются различные группы ферропрепаратов, в т. ч. препарат железа (III) протеин сукцинилат (Ферлатум). Высокая терапевтическая эффективность препаратов Ферлатум и Ферлатум Фол и хорошая переносимость при минимальных побочных явлениях позволяют рекомендовать их как препараты выбора для профилактики анемии, лечения латентного дефицита железа и ЖДА при беременности.
Ключевые слова: дефицит железа, железодефицитная анемия, беременность, ферропрепараты, железа (III) протеин сукцинилат, Ферлатум, Ферлатум Фол.
Для цитирования: Доброхотова Ю.Э., Бахарева И.В. Железодефицитная анемия беременных: профилактика и лечение. РМЖ. Медицинское обозрение. 2018;26(2(I)):59-64.
экономического развития региона. В статье подробно рассматриваются стадии развития дефицита железа, влияние анемии на развитие плода, диагностика, профилактика и лечение ЖДА у беременных. Лечение рассматривается как с позиций диетотерапии, так и с позиций медикаментозного лечения. Патогенетическими методами лечения ЖДА являются ферротерапия (пероральная и внутривенная), эритропоэзстимулирующие препараты в сочетании с ферротерапией и гемотрансфузии. Для лечения анемии и восполнения запасов железа в основном применяются пероральные препараты железа. Рассматриваются и сравниваются различные группы ферропрепаратов, в т. ч. препарат железа (III) протеин сукцинилат (Ферлатум). Высокая терапевтическая эффективность препаратов Ферлатум и Ферлатум Фол и хорошая переносимость при минимальных побочных явлениях позволяют рекомендовать их как препараты выбора для профилактики анемии, лечения латентного дефицита железа и ЖДА при беременности.
Ключевые слова: дефицит железа, железодефицитная анемия, беременность, ферропрепараты, железа (III) протеин сукцинилат, Ферлатум, Ферлатум Фол.
Для цитирования: Доброхотова Ю.Э., Бахарева И.В. Железодефицитная анемия беременных: профилактика и лечение. РМЖ. Медицинское обозрение. 2018;26(2(I)):59-64.
Iron deficiency anemia of pregnant women: prevention and treatment
Dobrokhotova Yu.E., Bakhareva I.V.
Pirogov Russian National Research Medical University, Moscow
Iron deficiency anemia (IDA) is one of the most common diseases in the world. In more than 90% of cases of anemia in pregnant women it is the iron deficiency anemia, while the frequency of IDA detection depends on the level of social and economic development of the region. The article describes in detail the stages of development of iron deficiency, the effect of anemia on fetal development, diagnosis, prevention and treatment of IDA in pregnant women. Treatment is considered both from the point of view of the diet therapy, and the appointment of drug treatment. Pathogenetic methods of IDA treatment are ferrotherapy (oral and intravenous), erythropoiesis stimulating drugs in combination with ferrotherapy and blood transfusion. The main drugs for anemia treatment and the replacement of iron reserves are oral iron preparations. Various groups of iron preparations are considered and compared, including the iron (III) containing drug succinylate protein (Ferlatum). High therapeutic efficacy of Ferlatum / Ferlatum Fol and its good tolerability with minimal side effects makes it possible to recommend it as a drug of choice for the prevention of anemia, treatment of latent iron deficiency and IDA during pregnancy.
Key words: iron deficiency, iron-deficiency anemia, pregnancy, iron preparations, iron (III) protein succinylate, Ferlatum, Ferlatum Fol.
For citation: Dobrokhotova Yu.E., Bakhareva I.V. Iron deficiency anemia of pregnant women: prevention and treatment //
RMJ. 2018. № 2(I). P.59 –64.
Dobrokhotova Yu.E., Bakhareva I.V.
Pirogov Russian National Research Medical University, Moscow
Iron deficiency anemia (IDA) is one of the most common diseases in the world. In more than 90% of cases of anemia in pregnant women it is the iron deficiency anemia, while the frequency of IDA detection depends on the level of social and economic development of the region. The article describes in detail the stages of development of iron deficiency, the effect of anemia on fetal development, diagnosis, prevention and treatment of IDA in pregnant women. Treatment is considered both from the point of view of the diet therapy, and the appointment of drug treatment. Pathogenetic methods of IDA treatment are ferrotherapy (oral and intravenous), erythropoiesis stimulating drugs in combination with ferrotherapy and blood transfusion. The main drugs for anemia treatment and the replacement of iron reserves are oral iron preparations. Various groups of iron preparations are considered and compared, including the iron (III) containing drug succinylate protein (Ferlatum). High therapeutic efficacy of Ferlatum / Ferlatum Fol and its good tolerability with minimal side effects makes it possible to recommend it as a drug of choice for the prevention of anemia, treatment of latent iron deficiency and IDA during pregnancy.
Key words: iron deficiency, iron-deficiency anemia, pregnancy, iron preparations, iron (III) protein succinylate, Ferlatum, Ferlatum Fol.
For citation: Dobrokhotova Yu.E., Bakhareva I.V. Iron deficiency anemia of pregnant women: prevention and treatment //
RMJ. 2018. № 2(I). P.59 –64.
Статья посвящена профилактике и лечению железодефицитной анемии беременных. Рассматриваются и сравниваются различные группы ферропрепаратов, в т. ч. препарат железа (III) протеин сукцинилат (Ферлатум).
Железодефицитная анемия (ЖДА) является одним из самых распространенных заболеваний в мире, а непосредственная связь ЖДА с социально-экономическими факторами позволяет оценивать масштаб проблемы как «эпидемический кризис здравоохранения» (epidemic public health crisis) [1]. В мире ЖДА страдают около 700 млн человек, в России ЖДА выявляется у 6—30% населения [2, 3]. Анемия беременных более чем в 90% случаев является железодефицитной, при этом частота выявления ЖДА зависит от уровня социально-экономического развития региона. Частота ЖДА у беременных в мире колеблется от 5,4% в развитых странах до более чем 80% в развивающихся странах [4–7].Этиология и патогенез
Анемия — клинико-лабораторный синдром, характеризующийся снижением уровня гемоглобина, эритроцитов и гематокрита в единице объема крови. Увеличение объема циркулирующей крови (ОЦК) на 40—45% преимущественно за счет объема циркулирующей плазмы сопровождается в течение беременности постепенным снижением гемоглобина и гематокрита, что принято считать физиологической анемией беременных. Cнижение гемоглобина менее 110 г/л в I и особенно в III триместре и менее 105 г/л во II триместре (5-й перцентиль) следует считать патологическим, обусловленным не только гемодилюцией беременности, но и дефицитом железа [8]. Согласно критериям Всемирной организации здравоохранения (ВОЗ), анемией беременных следует считать уровень содержания гемоглобина менее 110 г/л и гематокрита менее 33%, в развивающихся странах нижней границей уровня гемоглобина считается 100 г/л [9, 10].ЖДА — это гипохромная микроцитарная анемия, развивающаяся вследствие абсолютного уменьшения запасов железа в организме. При одноплодной беременности потребность в железе составляет около 1000 мг, при этом 300 мг необходимо на рост плода и плаценты, 500 мг — на увеличение синтеза материнского гемоглобина, 200 мг перераспределяются между пищеварительным трактом, мочевыделительной системой и кожей. Это количество — 1000 мг — существенно превышает запасы железа у женщин, поэтому без назначения препаратов железа развивается анемия. По мере увеличения ОЦК во II триместре дефицит железа проявляется значительным снижением гемоглобина. В III триместре увеличивается расход железа на нужды плода, при этом количество железа, транспортируемого плоду, при анемии матери обычно остается нормальным [11].
Стадии дефицита железа
Выделяют три стадии дефицита железа: предлатентный, латентный и манифестный (табл. 1). Предлатентный дефицит железа характеризуется снижением резервного железа без снижения расходования железа на эритропоэз; латентный дефицит железа (ЛДЖ) наблюдается при истощении запасов железа в депо и сопровождается дефицитом транспортного железа, но без признаков анемии; манифестный дефицит железа (МДЖ), или ЖДА, проявляется симптомом анемии [7, 12—14]. МДЖ у беременных подразделяется на два клинических варианта: МДЖ у беременных без хронического воспаления и МДЖ у беременных с хроническим воспалением. К заболеваниям, сопровождающимся воспалением у беременных с клиническим вариантом «МДЖ у беременных с хроническим воспалением», относятся: заболевания почек; инфекционно-воспалительные заболевания органов дыхания; урогенитальные инфекции (хламидиоз, трихомониаз, уреаплазмоз, бактериальный вагиноз и влагалищный кандидоз); вирусная инфекция (вирус простого герпеса, цитомегаловирус, ВИЧ, гепатит А, В, С); аутоиммунные заболевания; злокачественные новообразования и т. п. При МДЖ у беременных без хронического воспаления определяются нарушения во всех фондах метаболизма железа, при МДЖ у беременных с хроническим воспалением — во всех фондах, кроме запасного. При I стадии МДЖ у беременных с хроническим воспалением определяются нарушения в функциональном и регуляторном фондах, при отсутствии нарушений в транспортном фонде; при II стадии нарушен и транспортный фонд [12].Развитию ЖДА у беременных способствуют: дефицит железа в связи с его расходом на рост плода и плаценты; увеличение массы циркулирующих эритроцитов, повышающее потребность в железе; низкое алиментарное поступление железа при недостатке животного белка, а также сырых овощей и фруктов; недостаток витаминов, необходимых для усвоения железа (витамина С, В12, фолиевой кислоты и др.); ранний токсикоз, нарушающий поступление и всасывание в желудочно-кишечном тракте железа и других микроэлементов; другие осложнения беременности (преэклампсия, холестатический гепатоз), нарушающие синтез транспортных белков и депонирование ферритина и гемосидерина; высокий паритет и короткие интергенетические интервалы; многоплодная беременность; лактация; хронические инфекционные заболевания; паразитарные инфекции (малярия, анкилостомоз, шистосомоз), факторы окружающей среды, нарушающие усвоение железа (например, высокая минерализация питьевой воды) [14—17]. В недавнем африканском исследовании (Эфиопия), проведенном в популяции со средней частотой развития анемии беременных (ОР=23,2, 95% ДИ: 19,5%–26,9%), подтверждены следующие факторы риска анемии беременных: низкий социально-экономический статус (ОР=2,03; 95% ДИ: 1,11—3,69), II триместр (ОР=3,09; 95% ДИ: 1,41—6,79) и III триместр (ОР=3,68; 95% ДИ: 1,67—8,08), 3—5-я беременность (ОР=1,78; 95% ДИ: 1,03—3,07), 6-я беременность и более (ОР=2,59; 95% ДИ: 1,37—4,92), отсутствие ферротерапии (ОР=1,72; 95% ДИ: 1,02—2,91), низкий индекс диетического разнообразия (ОР=3,18; 95% ДИ: 1,37—7,37) и анкилостомоз (ОР=2,69, 95% ДИ: 1,34—5,39) [18].
Влияние анемии на течение беременности и перинатальные исходы
Дефицит железа, приводящий к гемодинамическим, обменным, иммунным и гормональным нарушениям, способствует осложненному течению беременности и родов, нарушению формирования плаценты, повышает риск перинатальной патологии, может быть одной из причин недоношенности, нарушений ранней неонатальной адаптации. При обследовании 27 000 беременных Klebanoff et al. выявили увеличение частоты преждевременных родов при анемии во II триместре беременности [19]. Ren и соавт. показали, что анемия беременных, диагностированная уже в I триместре, также повышает риск недонашивания беременности [20]. Согласно исследованию Kidanto et al., проведенному в популяции с низким социально-экономическим уровнем (Танзания), частота невынашивания беременности и синдрома задержки роста плода коррелирует со степенью тяжести анемии [5]. В недавнем метаанализе G. Badfar et al., включающем 620 080 беременных, показано, что частота синдрома задержки развития плода (СЗРП) возрастает при наличии анемии беременных в I триместре (ОР=1,11; 95% ДИ: 1—2,01; p=0,044), однако при наличии анемии во II триместре такой зависимости не выявлено (ОР=1,11; 95% ДИ: 0,85—1,18; р=0,091]) [21]. Анемия матери оказывает влияние на васкуляризацию плаценты, нарушая ангиогенез на ранних сроках беременности, может стать причиной преждевременной отслойки плаценты, кровотечения в последовом и раннем послеродовом периодах [22].Плод получает железо от матери за счет активного транспорта через плаценту главным образом в III триместре беременности. У новорожденных от матерей с ЖДА уровни ферритина, транспортного железа, коэффициента насыщения трансферрина железом значительно снижены. К возможным осложнениям у новорожденных от матери с анемией относятся СЗРП, недоношенность, физиологическая потеря массы тела новорожденным более 10%, длительное течение физиологической желтухи, повышение риска неонатальных инфекций. При тяжелой анемии возможно развитие латентного дефицита железа и анемии у новорожденных, а также отставание в психомоторном развитии детей первых лет жизни [13, 15, 23]. Скрининг на дефицит железа у детей рекомендуется проводить в возрасте 6—12 меc. [10].
Диагностика анемии беременных
Диагностика ЖДА основывается на клинических и гематологических признаках и включает определение уровня гемоглобина, гематокрита, индексов красной крови, тщательное исследование мазка периферической крови; определение уровня сывороточного железа и ферритина. Классические морфологические признаки ЖДА — гипохромия эритроцитов и микроцитоз — у беременных выражены в меньшей степени, чем у небеременных. Уровень ферритина сыворотки в норме при беременности несколько снижается [24], однако он может быть повышен при анемии воспаления, что часто затрудняет постановку диагноза [12]. Снижение уровня ферритина отражает истощение запасов железа. Согласно Российским федеральным рекомендациям, признаком ЖДА является уровень ферритина ниже 20 мкг/л [12], согласно данным Американской ассоциации акушеров-гинекологов — ниже 10—15 мкг/л [25]. У беременных с ЖДА снижается концентрация железа в сыворотке, повышается общая железосвязывающая способность сыворотки, латентная железосвязывающая способность и снижается коэффициент насыщения трансферрина железом [6, 12]. Коэффициент насыщения трансферрина железом <16% подтверждает железодефицитный характер анемии у беременных с ферритином сыворотки <20 мкг/л (см. табл. 1). Содержание железа в сыворотке крови в I триместре беременности выше, чем на более поздних сроках, что связано с положительным балансом железа вследствие аменореи и невысокой потребности в железе в начале беременности. Уровень сывороточного железа повышается на 2—4-й день после начала лечения железосодержащими препаратами, а затем снижается. При ЖДА возрастает количество трансферриновых рецепторов. Уровень эритропоэтина в сыворотке крови также повышается, достигая пика в начале III триместра беременности, что соответствует максимальной продукции эритроцитов [26]. Нормальный уровень сывороточного эритропоэтина независимо от возраста и пола составляет 5–30 МЕ/л.![Таблица 1. Диагностические критерии железодефицитных состояний у беременных [12] Таблица 1. Диагностические критерии железодефицитных состояний у беременных [12]](/upload/medialibrary/882/59-1.png)
МДЖ (ЖДА) в зависимости от уровня гемоглобина подразделяется на степени: тяжелую, среднюю и легкую. При анемии легкой степени содержание гемоглобина ниже 110 г/л у беременных и ниже 100 г/л у родильниц, но более 90 г/л; при средней степени — менее 89 г/л, но более 70 г/л; при тяжелой степени — менее 70 г/л [12]. Клинические признаки не всегда соответствуют степени тяжести анемии, определенной по лабораторным критериям, обычно они развиваются при анемии средней и тяжелой степени.
Симптоматика ЖДА (обычно при средней и тяжелой степени)
Симптомы, связанные с анемией (анемический синдром): бледность кожи и слизистых, головокружение, шум в ушах, головная боль, повышенная утомляемость, лабильность настроения, апатия, снижение работоспособности и ослабление способности к концентрации, бессонница, сонливость, тошнота, ортостатический коллапс, анемическая кома.Симптомы, связанные с дефицитом железосодержащих ферментов и миоглобина (сидеропенический синдром): ломкость ногтей, выпадение и ломкость волос, изменения кожи (сухость, шелушение, трещины) и слизистых оболочек, ангулярный стоматит, глоссит, синева склер, мышечная слабость, в т. ч. слабость сфинктеров, извращение вкуса и обоняния, дисфагия, ахлоргидрия и явления гастрита, одышка и сердцебиение при физической нагрузке, в запущенных случаях — миокардиодистрофия.
Профилактика анемии беременных
Медикаментозная профилактика ЖДА во время беременности, согласно рекомендациям ВОЗ, заключается в назначении не позднее начала II триместра беременности 60 мг элементарного железа в сутки [9]. К группам высокого риска по развитию ЖДА относятся пациентки с анемией в анамнезе; с меноррагией в анамнезе; многорожавшие; женщины с экстрагенитальной патологией, хроническими инфекционными заболеваниями; беременные с уровнем гемоглобина в I триместре <120 г/л; беременные с многоплодием; беременные с ранним токсикозом, преэклампсией [7, 27]. В развивающихся странах, где частота ЖДА может достигать 80% [4, 5], распространена рутинная профилактика, т. к. традиционная диета не обеспечивает женщин достаточным количеством железа, а некоторые инфекционные заболевания увеличивают риск железодефицита [17, 28, 29]. В развитых странах предпочтение отдается селективной профилактике: индивидуальный подход основан на рациональном назначении железозаместительной терапии на основании данных лабораторных анализов, свидетельствующих о наличии железодефицита (по уровню сывороточного ферритина) [16, 23, 30]. Однако и в развитых странах может быть рекомендовано рутинное использование железа: так, в США Американская ассоциация акушеров-гинекологов рекомендует 30 мг элементарного железа в сутки всем беременным на протяжении II и III триместров, а Центр по контролю и профилактике заболеваний и Американская диетическая ассоциация рекомендуют 30—60 мг элементарного железа в сутки всем беременным с момента первого обращения по поводу беременности [8, 25].Cогласно рекомендациям ВОЗ, во всех регионах в течение 6 мес. (II и III триместры) беременная должна получать стандартный комплекс, состоящий из железа (60 мг) и фолиевой кислоты (400 мкг) [9]. Пища беременной должна содержать железо, аскорбиновую кислоту, способствующую усвоению железа; также необходимо обогащать железом, фолатами и аскорбиновой кислотой некоторые продукты питания для беременных. Пищу не следует запивать чаем, который связывает железо и замедляет его всасывание [9].
Надо отметить, что рутинная профилактика ЖДА может сопровождаться осложнениями у пациенток с наследственным гемохроматозом, гемоглобинопатиями, метаболическими нарушениями (например, при кожной порфирии). Норвежским советом по здравоохранению разработана схема селективной профилактики, основанной на раннем (до 12 нед. беременности) определении сывороточного ферритина: при уровне его более 60 мкг/л препараты железа не показаны; при уровне
от 20 до 60 мкг/л назначение препаратов железа необходимо с 20-й недели; при уровне менее 20 мкг/л препараты железа необходимы с 12—14-й недели; при уровне менее 15 мкг/л показано незамедлительное лечения [31].
Лечение анемии беременных
Согласно приказу Минздрава России от 1 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю “акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий)”», ведение беременных с анемией на амбулаторном этапе включает: клинический анализ крови — 1 р./мес. с лейкоцитарной формулой, подсчетом ретикулоцитов и тромбоцитов; биохимический анализ крови (общий белок, сывороточное железо, ферритин, трансферрин, билирубин общий и прямой); другие исследования по назначению врача-терапевта; консультация врача-терапевта (врача-гематолога) и в дальнейшем динамическое наблюдение (1—2 р./мес.); ЭКГ в каждом триместре; уточнение диагноза и решение вопроса о возможности продолжения беременности при сроке до10 нед.; пункция костного мозга (по назначению врача-гематолога); кардиотокография и допплерометрия в динамике. Стационарный этап обследования и лечения включает диету, богатую белками, железом, витаминами и фолатами; препараты, содержащие железо; лечение основного и сопутствующих заболеваний (дифиллоботриоз, гиповитаминоз С); клинический анализ мочи, гемостазиограмма, коагулограмма; спектр для постановки диагноза железодефицитной анемии; консультации врача-трансфузиолога (при снижении гемоглобина до 70 г/л и ниже) [32].
При лечении ЖДА назначают сбалансированную диету, в которой в оптимальных сочетаниях и достаточном количестве содержатся необходимые питательные вещества, в т. ч. железо и белок [33, 34]. При установлении причины ЖДА лечение должно быть направлено на ее устранение (коррекция алиментарной недостаточности, лечение гиповитаминоза С, заболеваний ЖКТ и др.). Однако важно понимать, что возместить дефицит железа только с помощью диетотерапии невозможно.
Патогенетическое лечение ЖДА составляют ферротерапия (пероральная и внутривенная), эритропоэзстимулирующие препараты в сочетании с ферротерапией и гемотрансфузии. Для лечения анемии и восполнения запасов железа в основном применяются пероральные препараты железа. Существует мнение, что риски как низкого, так и чрезмерного потребления железа можно представить в виде U-образной кривой, с одной стороны которой — преждевременные роды и задержка роста плода, а с другой — гестационный сахарный диабет, гастроинтестинальные расстройства и с возрастом — нейродегенеративные заболевания [35, 36].
Препараты для парентерального введения могут вызывать аллергические реакции, т. к. у беременных с анемией снижено содержание трансферрина, способного связать быстро ионизируемое железо [37, 38]. Несомненными преимуществами обладает препарат железа для внутривенного введения — карбоксимальтозат, в котором благодаря углеводному компоненту минимизируется высвобождение лабильного свободного железа [39, 40]. Препарат рекомендуется для быстрой, высокоэффективной и безопасной коррекции анемии в конце III триместра беременности [39, 40].
При назначении препаратов железа критерием их эффективности является гематологический ответ, заключающийся в увеличении числа ретикулоцитов. Повышение уровня ретикулоцитов (ретикулоцитарный криз) отмечается на 8–12-й день при назначении препаратов железа в достаточной дозе, уровня гемоглобина — к концу 3-й недели. Скорость повышения уровня гемоглобина или гематокрита ниже, чем у небеременных, что связано с увеличением ОЦК при беременности. Оценку эффективности лечения МДЖ рекомендуется проводить через 2—3 нед. от начала лечения путем подсчета процентного роста значений гематологических показателей (гемоглобина, гематокрита, эритроцитов) по отношению к исходному уровню. Повышение гемоглобина менее чем на 6% (2% в неделю), гематокрита — менее чем на 1,5% (0,5% в неделю), эритроцитов — менее чем на 3% (1% в неделю) свидетельствует о неэффективности лечения [12]. Нормализация показателей красной крови наступает только через 5–8 нед. лечения, при этом общее состояние пациенток улучшается гораздо раньше. Эффективность лечения также контролируется по уровню трансферрина и ферритина сыворотки крови. Лечение анемии беременных должно быть длительным с коррекцией дозы. Для эффективного восполнения запасов железа пероральный прием железосодержащих препаратов следует продолжать в течение 2–3 мес. после коррекции анемии.
Сейчас в России представлены железосодержащие препараты, в которых железо содержится в составе разных композиций. В зависимости от химического строения можно условно разделить их на ионные солевые (преимущественно двухвалентные) и препараты железа (III) (протеин сукцинилат и гидроксид полимальтозного комплекса).
Первая группа — на основе неорганических солей — имеет ряд серьезных побочных эффектов. Особенно это относится к сульфату железа, т. к. он является жестким раздражителем ЖКТ. Более совершенные препараты следующих поколений (2-й и 3-й группы) основаны на органических солях, обладающих более высокой усвояемостью и лучшей переносимостью.
Особое внимание следует уделить дозам элементарного железа в составе различных препаратов для лечения ЖДА. Поскольку транспорт железа в энтероцит — процесс насыщаемый, т. е. энтероцит не может принять больше железа, чем способна его ферментативная система,— использование больших доз железа в препаратах неоправданно. Поэтому при выборе терапии железодефицита, особенно у беременных женщин, необходимо оценивать дозу элементарного железа в составе препарата. Градация препаратов по содержанию элементарного железа отражена в табл. 2.
Неконтролируемый прием железосодержащих препаратов может иметь печальные последствия. Хроническая перегрузка железом представляет не меньшую опасность для организма, чем его дефицит.
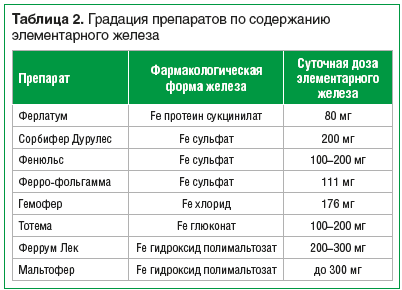
Безусловно, ВОЗ рекомендует начинать лечение анемии с пероральных препаратов. К сожалению, применение солевых препаратов железа, особенно их таблетированных форм без пролонгированного высвобождения, может вызывать токсичность и нежелательные побочные явления: боли в эпигастральной области, запор, понос, тошноту, рвоту; взаимодействие с другими лекарственными препаратами и пищей; выраженный металлический привкус; окрашивание эмали зубов и десен.
Во время беременности возникновение подобных жалоб особенно неприятно, приводит к низкой комплаентности и частому отказу пациенток от лечения (до 30—35%). Возможны передозировка и отравления солевыми препаратами железа из-за пассивного неконтролируемого всасывания. Кроме того, если определяется выраженное снижение Нb, то лечение следует начинать сразу с парентеральных форм.
Принимая во внимание вышесказанное, суточная дозировка 80 мг элементарного железа в белковом комплексе
железа (III) протеин сукцинилат является оптимальной с точки зрения эффективности и безопасности. Такая доза способствует усвоению железа, предотвращает развитие нежелательных явлений и как следствие — отказов от терапии и, по данным клинических исследований, способствует повышению уровня гемоглобина уже в 1-й месяц лечения на 28% [41].
Нежелательные побочные явления, характерные для солей двухвалентного железа, гораздо реже встречаются при использовании препаратов трехвалентного железа, таких как железа (III) протеин сукцинилат и гидроксид железа (III) полимальтозный комплекс. Современные препараты железа (III) имеют следующие свойства и преимущества: высокая безопасность, отсутствие риска передозировки, интоксикации и отравлений; отсутствие потемнения десен и зубов; приятный вкус; отличная переносимость; высокая комплаентность; отсутствие взаимодействия с другими лекарственными средствами и продуктами питания; наличие антиоксидантных свойств [3, 42].
Железа (III) протеин сукцинилат в профилактике и лечении анемии беременных
Большой клинический интерес представляет применение препарата Ферлатум — железа (III) протеин сукцинилат («Италфармако») в профилактике дефицита железа, лечении ЛДЖ и ЖДА. Препарат выпускается в форме раствора во флаконах по 15 мл, содержащих 800 мг железа (III) протеин сукцинилата (в пересчете на элементарное железо — 40 мг). Железа (III) протеин сукцинилат представляет собой комплексное соединение трехвалентного железа с белковым носителем. Белковый комплекс предотвращает повреждение слизистой оболочки желудка, а всасывание железа осуществляется после повторного растворения белковой оболочки в двенадцатиперстной кишке, т. е. железо высвобождается в месте его лучшего всасывания. Из кишечника в кровь трех-валентное железо поступает путем активного всасывания, что объясняет невозможность передозировки и отравления препаратом. Уникальная связь трехвалентного железа с молекулой белка в препарате способствует легкому усвоению железа и повышению уровня гемоглобина уже в первый месяц лечения. Благодаря уникальным свойствам белкового комплекса всасывание препарата не зависит от приема пищи, других лекарственных препаратов, поэтому принимать его можно во время или сразу после еды. Все перечисленные выше факторы говорят о том, что содержащееся в препарате железа (III) протеин сукцинилат трехвалентное железо легко усваивается. Именно благодаря физиологичному всасыванию железа (III) протеин сукцинилата, препарат Ферлатум одобрен к применению даже у новорожденных детей.Особый интерес представляют исследования, в которых проводилось сравнение между различными препаратами трехвалентного железа. Так, в работе F. Haliotis и D. Papanastasiou [43] оценивали эффективность применения железа (III) протеин сукцинилата и железа гидроксид полимальтозата в терапии сидеропении у детей. По результатам данного исследования, в группе детей, принимавших железа (III) протеин сукцинилат, было зафиксировано более быстрое улучшение показателей (гемоглобина, гематокрита, MCV, сывороточного железа, ферритина), чем в группе детей, принимавших железа гидроксид полимальтозат. Кроме того, улучшение в группе железа (III) протеин сукцинилата наступало быстрее, чем в группе железа гидроксид полимальтозата. При этом авторы отмечают, что пациенты лучше переносили терапию железа (III) протеин сукцинилатом, чем терапию железа гидроксид полимальтозатом. Подробные данные из этой работы отражены в таблице 3.
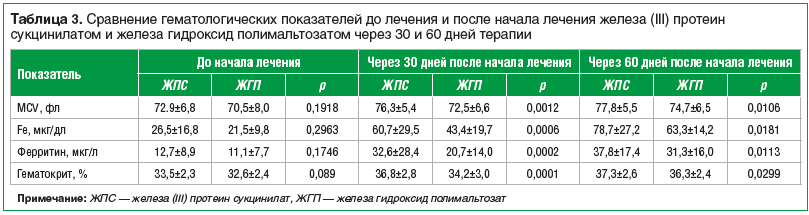
Для профилактики дефицита железа и лечения ЛДЖ назначается 1 флакон (15 мл) перорально 2 р./сут; для лечения ЖДА — 2 флакона в сутки по 15 мл, до нормализации уровня гемоглобина, после чего следует продолжать прием препарата по 1 флакону в сутки (поддерживающая доза) для восполнения запасов железа не менее 8–12 нед.
При недостаточности фолатов и в комплексном лечении анемии рекомендуется препарат Ферлатум Фол, содержащий дополнительно 0,235 мг кальция фолината пентагидрата (эквивалентно 0,185 мг фолиновой кислоты) — 100 мг порошка в запечатанной крышке-дозаторе. Препараты Ферлатум и Ферлатум Фол хорошо переносятся беременными, практически не вызывают диспепсических нарушений и изменений функции кишечника, совместимы с другими лекарственными препаратами, назначаемыми для лечения различных осложнений беременности.
Профилактическое назначение препарата Ферлатум — железа (III) протеин сукцинилата в дозе 800 мг (1 флакон, 40 мг элементарного железа) у здоровых беременных во II–III триместрах предупреждает развитие ЛДЖ и ЖДА и практически не имеет побочных эффектов.
Для диагностики ЛДЖ необходимо определение в I триместре уровня ферритина сыворотки и гематологических показателей, что позволяет своевременно начать лечение препаратом Ферлатум и предупредить развитие ЖДА и ассоциированных осложнений беременности.
Для лечения ЖДА дозу Ферлатума необходимо увеличить до 2-х флаконов (30 мл), контролировать динамику клинических и лабораторных показателей; после нормализации уровня гемоглобина для восстановления депо железа терапию Ферлатумом необходимо продолжать в течение 2—3-х месяцев в поддерживающей дозе (1 флакон — 15 мл).
Высокая терапевтическая эффективность и хорошая переносимость препаратов Ферлатум и Ферлатум Фол при минимальных побочных явлениях позволяют рекомендовать их как препараты выбора для профилактики анемии, лечения ЛДЖ и ЖДА при беременности.
Литература
1. Friedrisch J. R., Friedrisch B. K. Prophylactic Iron Supplementation in Pregnancy: A Controversial Issue // Biochem Insights. 2017. Vol. 27. P. 10. doi: 10.1177/1178626417737738.
2. Железодефицитная анемия. Клинические рекомендации (протоколы лечения). Национальный стандарт Российской федерации (проект). М. 2015 [Zhelezodeficitnaja anemija. Klinicheskie rekomendacii (protokoly lechenija). Nacional’nyj standart Rossijskoj federacii (proekt). M. 2015 (in Russian)].
3. Федеральные клинические рекомендации по диагностике и лечению железодефицитной анемии. М. 2014. 53 с. [Federal’nye klinicheskie rekomendacii po diagnostike i lecheniju zhelezodeficitnoj anemii. M. 2014. 53 s. (in Russian)].
4. Sun D., McLeod A., Gandhi S. et al. Anemia in Pregnancy: A Pragmatic Approach // Obstet Gynecol Surv. 2017. Vol. 72 (12). P. 730–737. doi: 10.1097/OGX.0000000000000510
5. Kidanto H. L., Mogren I., Lindmark G. et al. Risks for preterm delivery and low birth weight are independently increased by severity of maternal anaemia // S. Afr.Med.J. 2009. Vol. 99 (2). P. 98.
6. Коноводова Е. Н., Бурлев В. А. Железодефицитные состояния у беременных и родильниц // Акушерство и гинекология. 2012. № 1. С. 137–142 [Konovodova E.N., Burlev V. A. Zhelezodeficitnye sostojanija u beremennyh i rodil’nic // Akusherstvo i ginekologija. 2012. № 1. S. 137–142 (in Russian)].
7. Серов В. Н., Бурлев В. А., Коноводова Е. Н. Железодефицитные состояния у беременных и родильниц. Алгоритмы диагностики и лечения гинекологических заболеваний. М.: Литтерра. 2008. 160 с. [Serov V.N., Burlev V. A., Konovodova E. N. Zhelezodeficitnye sostojanija u beremennyh i rodil’nic. Algoritmy diagnostiki i lechenija ginekologicheskih zabolevanij. M.: Litterra. 2008. 160 s. (in Russian)].
8. Centers for Disease Control and Prevention: Recommendations to prevent and control iron deficiency in the United States // MMWR. 1998. Vol. 47. P. 1.
9. UNICEF, United Nations University, WHO. Iron deficiency anemia: assessment, prevention and control. A guide for programme managers. Geneva: World Health Organization. 2001 (WHO/NHD/Ol.3) 114 p.
10. Taylor C. L., Brannon P. M. Introduction to workshop on iron screening and supplementation in iron-replete pregnant women and young children // Am J Clin Nutr. 2017. Vol. 106 (Suppl 6). P. 1547–1554. doi: 10.3945/ajcn.117.155747.
11. Williams Obstetrics 24th Edition. Edited by F. Gary Cunningham et al. English /ISBN: 0071798935. 2014. 1376 p.
12. Федеральные клинические рекомендации. Диагностика, профилактика и лечение железодефицитных состояний у беременных и родильниц. РОАГ, ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. В. И. Кулакова» Минздрава России. М. 2013 [Federal’nye klinicheskie rekomendacii. Diagnostika, profilaktika i lechenie zhelezodeficitnyh sostojanij u beremennyh i rodil’nic. ROAG, FGBU «Nauchnyĭ centr akusherstva, ginekologii i perinatologii im. V. I. Kulakova» Minzdrava Rossii. M. 2013 (in Russian)].
13. Коноводова Е. Н., Бурлев В. А., Тютюнник В. Л. и др. Эффективность терапии латентного дефицита железа у беременных // Вопросы гинекологии, акушерства и перинатологии. 2011. № 10 (5). С. 26–30 [Konovodova E.N., Burlev V. A., Tjutjunnik V. L. i dr. Jeffektivnost’ terapii latentnogo deficita zheleza u beremennyh // Voprosy ginekologii, akusherstva i perinatologii. 2011. № 10 (5). S. 26–30 (in Russian)].
14. Протопопова Т. А. Железодефицитная анемия и беременность // РМЖ. 2012. № 17. С. 862–867 [Protopopova T. A. Zhelezodeficitnaja anemija i beremennost’ // RMZh. 2012. № 17. S. 862–867 (in Russian)].
15. Lozoff B. Iron deficiency and child development // Food Nutr. Bull. 2007. Vol. 28. P. 560–571.
16. Bencaiova G., Burkhardt T., Breymann C. Anemia – prevalence and risk factors in pregnancy // Eur. J. Intern. Med. 2012. Vol. 23 (6). P. 529–533.
17. Di Renzo G. C., Spano F., Giardina I., et al. Iron deficiency anemia in pregnancy // Womens Health (Lond). 2015. Vol. 11 (6). P. 891–900. doi: 10.2217/whe.15.35. Epub 2015 Oct 16.
18. Lebso M., Anato A., Loha E. Prevalence of anemia and associated factors among pregnant women in Southern Ethiopia: A community based cross-sectional study // PLoS One. 2017. Vol. 12 (12). P. e0188783. doi: 10.1371/journal.pone.0188783.
19. Klebanoff M. A., Shiono P. H., Selby J. V. et al. Anemia and spontaneous preterm birth // Am. J. Obstet. Gynecol. 1991. Vol. 164. P. 59.
20. Ren A., Wang J., Ye R. W. et al. Low first-trimester hemoglobin and low birth weight, preterm birth and small for gestational age newborns // Int. J. Gynaecol. Obstet. 2007. Vol. 98. P. 124.
21. Badfar G., Shohani M., Soleymani A., Azami M. Maternal anemia during pregnancy and small for gestational age: A systematic review and meta-analysis // J Matern Fetal Neonatal Med. 2017. Vol. 1. P.131. doi: 10.1080/14767058.2017.1411477.
22. Kadyrov M., Kosanke G., Kingdom J. et al. Increased fetoplacental angiogenesis during first trimester in anaemic women // Lancet 1998. Vol. 352. P. 1747.
23. Shao J., Lou J, Rao R. et al. Maternal serum ferritin concentration is positively associated with newborn iron stores in women with low ferritin status in late pregnancy // J. Nutr. 2012. Vol. 142 (11). P. 2004–2009.
24. Goldenberg R. L., Tamura T., DuBard M. et al. Plasma ferritin and pregnancy outcome // Am. J. Obstet. Gynecol. 1996. Vol. 175. P. 1356.
25. American College of Obstetricians and Gynecologists: Anemia in pregnancy. Committee Opinion No.95. 2008
26. Clapp J. F., Little K. D., Widness J. A. Effect of maternal exercise and fetoplacental growth rate on serum erythropoietin concentrations // Am. J. Obstet. Gynecol. 2003. Vol. 188. P. 1021.
27. Choudhury N., Aimone A., Hyder S. M., Zlotkin S. H. Relative efficacy of micronutrient powders versus iron–folic acid tablets in controlling anemia in women in the second trimester of pregnancy // Food Nutr. Bull. 2012. Vol. 33 (2). P. 142–149.
28. Haider B. A., Bhutta Z. A. Multiple-micronutrient supplementation for women during pregnancy // Cochrane Database Syst Rev. 2015. Vol. 11. CD004905. doi: 10.1002/14651858.CD004905.pub4.
29. Haider B. A., Bhutta Z. A. Multiple-micronutrient supplementation for women during pregnancy // Cochrane Database Syst Rev. 2017. Vol. 4. CD004905. doi: 10.1002/14651858.CD004905.pub5.
30. Milman N. Prepartum anaemia: prevention and treatment // Ann. Hematol. 2008. Vol. 87. P. 949–959.
31. Haram K., Nilsen S., Ulvik R. Iron supplementation in pregnancy – evidence and controversies // Acta Obstet Gynecol Scand. 2001. Vol. 80. P. 683–688.
32. Приказ Министерства здравоохранения РФ от 1 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю “акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий) ”». 2012 [Prikaz Ministerstva zdravoohranenija RF ot 1 nojabrja 2012 g. N 572n «Ob utverzhdenii Porjadka okazanija medicinskoj pomoshhi po profilju “akusherstvo i ginekologija (za iskljucheniem ispol’zovanija vspomogatel’nyh reproduktivnyh tehnologij) ”». 2012 (in Russian)].
33. Хух Р., Брейман К. Анемия во время беременности и в послеродовом периоде. М.: Триада-Х. 2007. 73 с. [Huh R., Brejman K. Anemija vo vremja beremennosti i v poslerodovom periode. M.: Triada-H. 2007. 73 s. (in Russian)].
34. Тютюнник В. Л., Балушкина А. А., Докуева Р. С. Профилактика и лечение железодефицитной анемии при беременности // РМЖ. 2013. № 1. С. 22 [Tjutjunnik V.L., Balushkina A. A., Dokueva R. S. Profilaktika i lechenie zhelezodeficitnoj anemii pri beremennosti // RMZh. 2013. № 1. S. 22 (in Russian)].
35. Brannon P. M., Taylor C. L. Iron Supplementation during Pregnancy and Infancy: Uncertainties and Implications for Research and Policy // Nutrients. 2017. Vol. 9 (12). pii: E1327. doi: 10.3390/nu9121327.
36. Iqbal S., Ekmekcioglu C. Maternal and neonatal outcomes related to iron supplementation or iron status: a summary of meta-analyses // J Matern Fetal Neonatal Med. 2017. Vol. 1. P. 13. doi: 10.1080/14767058.2017.1406915.
37. Kochhar P. K., Kaundal A., Ghosh P. Intravenous iron sucrose versus oral iron in treatment of iron deficiency anemia in pregnancy: A randomized clinical trial // J. Obstet. Gynaecol. Res. 2012. Vol. 26. P. 1–7.
38. Bencaiova G., von Mandach U., Zimmermann R. Iron prophylaxis in pregnancy: intravenous route versus oral route // Eur. J. Obstet. Gynecol. Reprod. Biol. 2009. Vol. 144 (2). P. 135–139.
39. Breymann C., Auerbach M. Iron deficiency in gynecology and obstetrics: clinical implications and management // Hematology Am Soc Hematol Educ Program. 2017. Vol. 2017 (1). P. 152–159. doi: 10.1182/asheducation-2017.1.152.
40. Breymann C., Milman N., Mezzacasa A. et al. Ferric carboxymaltose vs. oral iron in the treatment of pregnant women with iron deficiency anemia: an international, open-label, randomized controlled trial (FER-ASAP) // J Perinat Med. 2017. Vol. 45 (4). P. 443–453. doi: 10.1515/jpm-2016–0050.
41. Яглов В. Железодефицитные состояния у больных с маточными кровотечениями // Гинекология. 2005. № 1. С. 54–56 [Jaglov V. Zhelezodeficitnye sostojanija u bol’nyh s matochnymi krovotechenijami // Ginekologija. 2005. № 1. S. 54–56 (in Russian)].
42. Доброхотова Ю. Э., Бахарева И. В. Железодефицитная анемия: профилактика и лечение при беременности // Лечебное дело. 2016. № 3. С. 4–14 [Dobrohotova Ju.Je., Bahareva I. V. Zhelezodeficitnaja anemija: profilaktika i lechenie pri beremennosti // Lechebnoe delo. 2016. № 3. S. 4–14 (in Russian)].
43. Haliotis F. A., Papanastasiou D. A. Comparative study of tolerability and efficacy of iron protein succinylate versus iron hydroxide polymaltose complex in the treatment of iron deficiency in children // Int J Clin Pharmacol Ther. 1998. Vol. 36 (6). P. 320–325.
2. Железодефицитная анемия. Клинические рекомендации (протоколы лечения). Национальный стандарт Российской федерации (проект). М. 2015 [Zhelezodeficitnaja anemija. Klinicheskie rekomendacii (protokoly lechenija). Nacional’nyj standart Rossijskoj federacii (proekt). M. 2015 (in Russian)].
3. Федеральные клинические рекомендации по диагностике и лечению железодефицитной анемии. М. 2014. 53 с. [Federal’nye klinicheskie rekomendacii po diagnostike i lecheniju zhelezodeficitnoj anemii. M. 2014. 53 s. (in Russian)].
4. Sun D., McLeod A., Gandhi S. et al. Anemia in Pregnancy: A Pragmatic Approach // Obstet Gynecol Surv. 2017. Vol. 72 (12). P. 730–737. doi: 10.1097/OGX.0000000000000510
5. Kidanto H. L., Mogren I., Lindmark G. et al. Risks for preterm delivery and low birth weight are independently increased by severity of maternal anaemia // S. Afr.Med.J. 2009. Vol. 99 (2). P. 98.
6. Коноводова Е. Н., Бурлев В. А. Железодефицитные состояния у беременных и родильниц // Акушерство и гинекология. 2012. № 1. С. 137–142 [Konovodova E.N., Burlev V. A. Zhelezodeficitnye sostojanija u beremennyh i rodil’nic // Akusherstvo i ginekologija. 2012. № 1. S. 137–142 (in Russian)].
7. Серов В. Н., Бурлев В. А., Коноводова Е. Н. Железодефицитные состояния у беременных и родильниц. Алгоритмы диагностики и лечения гинекологических заболеваний. М.: Литтерра. 2008. 160 с. [Serov V.N., Burlev V. A., Konovodova E. N. Zhelezodeficitnye sostojanija u beremennyh i rodil’nic. Algoritmy diagnostiki i lechenija ginekologicheskih zabolevanij. M.: Litterra. 2008. 160 s. (in Russian)].
8. Centers for Disease Control and Prevention: Recommendations to prevent and control iron deficiency in the United States // MMWR. 1998. Vol. 47. P. 1.
9. UNICEF, United Nations University, WHO. Iron deficiency anemia: assessment, prevention and control. A guide for programme managers. Geneva: World Health Organization. 2001 (WHO/NHD/Ol.3) 114 p.
10. Taylor C. L., Brannon P. M. Introduction to workshop on iron screening and supplementation in iron-replete pregnant women and young children // Am J Clin Nutr. 2017. Vol. 106 (Suppl 6). P. 1547–1554. doi: 10.3945/ajcn.117.155747.
11. Williams Obstetrics 24th Edition. Edited by F. Gary Cunningham et al. English /ISBN: 0071798935. 2014. 1376 p.
12. Федеральные клинические рекомендации. Диагностика, профилактика и лечение железодефицитных состояний у беременных и родильниц. РОАГ, ФГБУ «Научный центр акушерства, гинекологии и перинатологии им. В. И. Кулакова» Минздрава России. М. 2013 [Federal’nye klinicheskie rekomendacii. Diagnostika, profilaktika i lechenie zhelezodeficitnyh sostojanij u beremennyh i rodil’nic. ROAG, FGBU «Nauchnyĭ centr akusherstva, ginekologii i perinatologii im. V. I. Kulakova» Minzdrava Rossii. M. 2013 (in Russian)].
13. Коноводова Е. Н., Бурлев В. А., Тютюнник В. Л. и др. Эффективность терапии латентного дефицита железа у беременных // Вопросы гинекологии, акушерства и перинатологии. 2011. № 10 (5). С. 26–30 [Konovodova E.N., Burlev V. A., Tjutjunnik V. L. i dr. Jeffektivnost’ terapii latentnogo deficita zheleza u beremennyh // Voprosy ginekologii, akusherstva i perinatologii. 2011. № 10 (5). S. 26–30 (in Russian)].
14. Протопопова Т. А. Железодефицитная анемия и беременность // РМЖ. 2012. № 17. С. 862–867 [Protopopova T. A. Zhelezodeficitnaja anemija i beremennost’ // RMZh. 2012. № 17. S. 862–867 (in Russian)].
15. Lozoff B. Iron deficiency and child development // Food Nutr. Bull. 2007. Vol. 28. P. 560–571.
16. Bencaiova G., Burkhardt T., Breymann C. Anemia – prevalence and risk factors in pregnancy // Eur. J. Intern. Med. 2012. Vol. 23 (6). P. 529–533.
17. Di Renzo G. C., Spano F., Giardina I., et al. Iron deficiency anemia in pregnancy // Womens Health (Lond). 2015. Vol. 11 (6). P. 891–900. doi: 10.2217/whe.15.35. Epub 2015 Oct 16.
18. Lebso M., Anato A., Loha E. Prevalence of anemia and associated factors among pregnant women in Southern Ethiopia: A community based cross-sectional study // PLoS One. 2017. Vol. 12 (12). P. e0188783. doi: 10.1371/journal.pone.0188783.
19. Klebanoff M. A., Shiono P. H., Selby J. V. et al. Anemia and spontaneous preterm birth // Am. J. Obstet. Gynecol. 1991. Vol. 164. P. 59.
20. Ren A., Wang J., Ye R. W. et al. Low first-trimester hemoglobin and low birth weight, preterm birth and small for gestational age newborns // Int. J. Gynaecol. Obstet. 2007. Vol. 98. P. 124.
21. Badfar G., Shohani M., Soleymani A., Azami M. Maternal anemia during pregnancy and small for gestational age: A systematic review and meta-analysis // J Matern Fetal Neonatal Med. 2017. Vol. 1. P.131. doi: 10.1080/14767058.2017.1411477.
22. Kadyrov M., Kosanke G., Kingdom J. et al. Increased fetoplacental angiogenesis during first trimester in anaemic women // Lancet 1998. Vol. 352. P. 1747.
23. Shao J., Lou J, Rao R. et al. Maternal serum ferritin concentration is positively associated with newborn iron stores in women with low ferritin status in late pregnancy // J. Nutr. 2012. Vol. 142 (11). P. 2004–2009.
24. Goldenberg R. L., Tamura T., DuBard M. et al. Plasma ferritin and pregnancy outcome // Am. J. Obstet. Gynecol. 1996. Vol. 175. P. 1356.
25. American College of Obstetricians and Gynecologists: Anemia in pregnancy. Committee Opinion No.95. 2008
26. Clapp J. F., Little K. D., Widness J. A. Effect of maternal exercise and fetoplacental growth rate on serum erythropoietin concentrations // Am. J. Obstet. Gynecol. 2003. Vol. 188. P. 1021.
27. Choudhury N., Aimone A., Hyder S. M., Zlotkin S. H. Relative efficacy of micronutrient powders versus iron–folic acid tablets in controlling anemia in women in the second trimester of pregnancy // Food Nutr. Bull. 2012. Vol. 33 (2). P. 142–149.
28. Haider B. A., Bhutta Z. A. Multiple-micronutrient supplementation for women during pregnancy // Cochrane Database Syst Rev. 2015. Vol. 11. CD004905. doi: 10.1002/14651858.CD004905.pub4.
29. Haider B. A., Bhutta Z. A. Multiple-micronutrient supplementation for women during pregnancy // Cochrane Database Syst Rev. 2017. Vol. 4. CD004905. doi: 10.1002/14651858.CD004905.pub5.
30. Milman N. Prepartum anaemia: prevention and treatment // Ann. Hematol. 2008. Vol. 87. P. 949–959.
31. Haram K., Nilsen S., Ulvik R. Iron supplementation in pregnancy – evidence and controversies // Acta Obstet Gynecol Scand. 2001. Vol. 80. P. 683–688.
32. Приказ Министерства здравоохранения РФ от 1 ноября 2012 г. № 572н «Об утверждении Порядка оказания медицинской помощи по профилю “акушерство и гинекология (за исключением использования вспомогательных репродуктивных технологий) ”». 2012 [Prikaz Ministerstva zdravoohranenija RF ot 1 nojabrja 2012 g. N 572n «Ob utverzhdenii Porjadka okazanija medicinskoj pomoshhi po profilju “akusherstvo i ginekologija (za iskljucheniem ispol’zovanija vspomogatel’nyh reproduktivnyh tehnologij) ”». 2012 (in Russian)].
33. Хух Р., Брейман К. Анемия во время беременности и в послеродовом периоде. М.: Триада-Х. 2007. 73 с. [Huh R., Brejman K. Anemija vo vremja beremennosti i v poslerodovom periode. M.: Triada-H. 2007. 73 s. (in Russian)].
34. Тютюнник В. Л., Балушкина А. А., Докуева Р. С. Профилактика и лечение железодефицитной анемии при беременности // РМЖ. 2013. № 1. С. 22 [Tjutjunnik V.L., Balushkina A. A., Dokueva R. S. Profilaktika i lechenie zhelezodeficitnoj anemii pri beremennosti // RMZh. 2013. № 1. S. 22 (in Russian)].
35. Brannon P. M., Taylor C. L. Iron Supplementation during Pregnancy and Infancy: Uncertainties and Implications for Research and Policy // Nutrients. 2017. Vol. 9 (12). pii: E1327. doi: 10.3390/nu9121327.
36. Iqbal S., Ekmekcioglu C. Maternal and neonatal outcomes related to iron supplementation or iron status: a summary of meta-analyses // J Matern Fetal Neonatal Med. 2017. Vol. 1. P. 13. doi: 10.1080/14767058.2017.1406915.
37. Kochhar P. K., Kaundal A., Ghosh P. Intravenous iron sucrose versus oral iron in treatment of iron deficiency anemia in pregnancy: A randomized clinical trial // J. Obstet. Gynaecol. Res. 2012. Vol. 26. P. 1–7.
38. Bencaiova G., von Mandach U., Zimmermann R. Iron prophylaxis in pregnancy: intravenous route versus oral route // Eur. J. Obstet. Gynecol. Reprod. Biol. 2009. Vol. 144 (2). P. 135–139.
39. Breymann C., Auerbach M. Iron deficiency in gynecology and obstetrics: clinical implications and management // Hematology Am Soc Hematol Educ Program. 2017. Vol. 2017 (1). P. 152–159. doi: 10.1182/asheducation-2017.1.152.
40. Breymann C., Milman N., Mezzacasa A. et al. Ferric carboxymaltose vs. oral iron in the treatment of pregnant women with iron deficiency anemia: an international, open-label, randomized controlled trial (FER-ASAP) // J Perinat Med. 2017. Vol. 45 (4). P. 443–453. doi: 10.1515/jpm-2016–0050.
41. Яглов В. Железодефицитные состояния у больных с маточными кровотечениями // Гинекология. 2005. № 1. С. 54–56 [Jaglov V. Zhelezodeficitnye sostojanija u bol’nyh s matochnymi krovotechenijami // Ginekologija. 2005. № 1. S. 54–56 (in Russian)].
42. Доброхотова Ю. Э., Бахарева И. В. Железодефицитная анемия: профилактика и лечение при беременности // Лечебное дело. 2016. № 3. С. 4–14 [Dobrohotova Ju.Je., Bahareva I. V. Zhelezodeficitnaja anemija: profilaktika i lechenie pri beremennosti // Lechebnoe delo. 2016. № 3. S. 4–14 (in Russian)].
43. Haliotis F. A., Papanastasiou D. A. Comparative study of tolerability and efficacy of iron protein succinylate versus iron hydroxide polymaltose complex in the treatment of iron deficiency in children // Int J Clin Pharmacol Ther. 1998. Vol. 36 (6). P. 320–325.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья

