Устойчивость к антибиотикам Helicobacter pylori: обзор эпидемиологических тенденций и проблемы терапии
Рубрика:
Гастроэнтерология
Helicobacter pylori является одним из самых распространенных глобальных патогенов. У многих инфицированных людей хеликобактерная инфекция приводит к болезням верхнего отдела ЖКТ, включая язвенную болезнь и рак желудка.
Распространенность резистентности H. pylori к антибиотикам зависит от географического региона и, по имеющимся данным, растет во многих странах мира. Эффективность лечения хеликобактерной инфекции снижается во всех регионах, по которым есть данные. За последнее десятилетие увеличилась частота встречаемости случаев инфекции H. pylori, устойчивых к кларитромицину, которые в настоящее время составляют 30% от всех случаев в Японии и Италии, 50% в Китае и 40% в Турции. В то же время частота встречаемости резистентности к кларитромицину намного ниже (примерно 15%) в Швеции и на Тайване. Резистентность к другим антибиотикам также растет, хотя и не столь быстро.
Эффективная антибиотикотерапия основывается на информации о резистентности патогена к антибиотикам. Во многих регионах мира существует необходимость в описании региональной частоты встречаемости резистентности клинических изолятов H. pylori. Остро ощущается потребность в быстрых тестах для определения антибиотикорезистентности. Увеличение частоты эрадикации возбудителя возможно посредством подбора схем лечения. Обоснованный выбор антибиотиков в перспективе может привести к снижению встречаемости антибиотикорезистентности в популяции патогена.
Ключевые слова: Helicobacter pylori, антибиотик, устойчивость, распространенность, лечение, стратегия терапии.
Распространенность резистентности H. pylori к антибиотикам зависит от географического региона и, по имеющимся данным, растет во многих странах мира. Эффективность лечения хеликобактерной инфекции снижается во всех регионах, по которым есть данные. За последнее десятилетие увеличилась частота встречаемости случаев инфекции H. pylori, устойчивых к кларитромицину, которые в настоящее время составляют 30% от всех случаев в Японии и Италии, 50% в Китае и 40% в Турции. В то же время частота встречаемости резистентности к кларитромицину намного ниже (примерно 15%) в Швеции и на Тайване. Резистентность к другим антибиотикам также растет, хотя и не столь быстро.
Эффективная антибиотикотерапия основывается на информации о резистентности патогена к антибиотикам. Во многих регионах мира существует необходимость в описании региональной частоты встречаемости резистентности клинических изолятов H. pylori. Остро ощущается потребность в быстрых тестах для определения антибиотикорезистентности. Увеличение частоты эрадикации возбудителя возможно посредством подбора схем лечения. Обоснованный выбор антибиотиков в перспективе может привести к снижению встречаемости антибиотикорезистентности в популяции патогена.
Ключевые слова: Helicobacter pylori, антибиотик, устойчивость, распространенность, лечение, стратегия терапии.
D.G. Ahmetova1, A.Zh. Baltabekova2, A.V. Shustov2
1 Republican Diagnostic Center, Astana
2 National Center for Biotechnology, Astana
Helicobacter pylori (HP) is one of the most common global pathogens. Helicobacter infection leads in many infected people to development of upper GI tract diseases, including peptic ulcers and gastric cancer.
Prevalence of HP resistance to antibiotics depends on geographical region and according to available data it is growing in many countries. Effectiveness of HP infection treatment is declining in all region due to available data. Last decade is characterised by growth of incidence of HP resistance to clarithromycin, which currently account for 30% of cases in Japan and Italy, 50% in China and 40% in Turkey. At the same time, the incidence of clarithromycin resistance is much lower (about 15%) in Sweden and Taiwan. Resistance to other antibiotics is also growing, though not so fast.
Effective antibiotic therapy is based on data about pathogen resistance to antibiotics. There is a need in describing the regional frequency of antibiotic resistance of clinical isolates of HP in many regions of the world. Rapid test for HP antibiotic resistance assessment is highly anticipated. Increasing of HP eradication frequency is possible through selection of treatment regimens. Reasonable selection of antibiotics in the long term can reduce the prevalence of antimicrobial resistance in pathogen population.
Key words: helicobacter pylori, antibiotic, resistance, prevalence, treatment, therapeutic strategies.
For citation: Ahmetova D.G., Baltabekova A.Zh., Shustov A.V. Antibiotic resistance of Helicobacter pylori: review of epidemiological trends and problems of treatment // RMJ. Medical Review. 2018. № 7(I). P.13 –18.
В статье представлены обзор эпидемиологических тенденций и проблемы терапии устойчивости к антибиотикам Helicobacter pylori
Введение
Бактерия H. pylori является глобально распространенным условно-патогенным микроорганизмом и колонизирует примерно 50% населения мира [1]. Данный патоген был впервые обнаружен в биопсиях желудка в 1983 г. [2]. H.pylori — это грамотрицательная бацилла, которая колонизирует слизистую оболочку желудка человека. У многих людей такая инфекция со временем приводит к хроническому гастриту, язвенной болезни желудка, лимфоме лимфоидной ткани слизистой оболочки (MALT) и карциноме желудка. Не так давно было высказано предположение, что H.pylori может быть связанаи с внекишечными заболеваниями, такими как тромбоцитопеническая пурпура, железодефицитная анемия и дефицит витамина В12 [3, 4].
Современное состояние терапии хеликобактерной инфекции характеризуется большим числом неуспешных случаев лечения, так, в США примерно в 20% случаев не удается добиться эрадикации возбудителя из организма пациента. Процент успешности антибиотикотерапии в некоторых странах ниже — до 60%. Считается, что неуспешные случаи терапии вызваны антибиотико-резистентными изолятами. Значение антибиотико-
резистентности будет все более возрастать с учетом того, что лечение назначается все большему количеству больных в мире [5, 6]. В последних Маастрихтских рекомендациях есть положение о том, что в регионах с высокой частотой устойчивости H. pylori к кларитромицину необходимо до назначения терапии тестировать восприимчивость возбудителя к антибиотикам [1]. Данная идея получила развитие в решениях Киотского глобального консенсусного совещания по хеликобактерной инфекции: в каждом регионе мира нужно применять только такие схемы лечения, которые обеспечивают эрадикацию не менее чем в 90% случаев. Целью разработки новых схем лечения объявлено достижение 100% эрадикации [7].
Распространенность инфекции H. pylori
Заражение H. pylori происходит во всем мире, но при этом наблюдаются географические различия в распространенности инфекции. Многочисленные исследования показали, что низкий социально-экономический статус ассоциируется с повышенным риском инфекции H.pylori. В когортных исследованиях обнаружено, что инфицированность в обследованных популяциях возрастает с возрастом. В Европе распространенность H. pylori варьирует от 11% в Швеции до 60,3% в Испании. В Китае сообщили об очень высоком уровне встречаемости — до 83,4% [8]. Во многих странах, включая Китай, Японию и Болгарию, отмечен рост распространенности инфекции H.pylori в течение последних 20 лет (рис. 1) [9–13]. В Канаде распространенность инфекции в среднем составляет 30%, однако у коренных народов этой страны превышает 95%. В США серопозитивность на иммунологические маркеры инфекции составляет 30% [14]. Отмечено, что в популяциях с высокой встречаемостью пациенты заражены более чем одним штаммом H. pylori.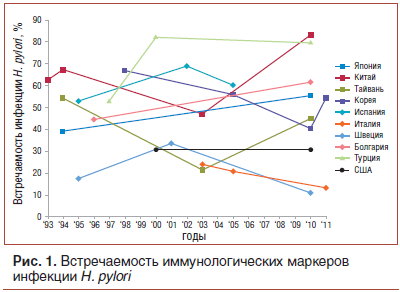
Распространенность устойчивости к антибиотикам
Распространенность антибиотикорезистентности H. py-lori разнится по географическим районам [15]. Распространенность хеликобактерной инфекции в США не изменилась с 2000 по 2010 г., но частота успешной эрадикации инфекции снизилась в этот период [1, 6, 13, 16].
Европейское многоцентровое исследование, проведенное с 2008 по 2009 г., показало частоту встречаемости резистентности случаев инфекции H. pylori к кларитромицину, метронидазолу и левофлоксацину: 17,5%, 34,9% и 14,1% соответственно [5]. Исследование, выполненное в Японии в 2002–2005 гг., выявило быстрый рост случаев инфекции, вызванных кларитромицин-устойчивым штаммом H. pylori; уровень резистентности к кларитромицину увеличился с 18,9 до 27,7% за указанный 3-летний период. Резистентность к метронидазолу в этот период оставалась на одном уровне (3,3–5,3%), а устойчивость к амоксициллину практически не встречалась. В исследовании консорциума SHARP (Surveillance of H. pylori Antimicrobial Resistance Partnership) выполнен метаанализ данных, собранных с 1993 по 1999 г., и показано, что уровень резистентности к кларитромицину, метронидазолу и амоксициллину составил 10,1, 36,9 и 1,4% соответственно. Проспективное многоцентровое исследование HARP (Helicobacter pylori Antimicrobial Resistance Monitoring Program) проводилось в период 1998–2002 гг. и продемонстрировало резистентность к кларитромицину, метронидазолу и амоксициллину в 12,9, 25,1 и 0,9% случаев соответственно.
Существует веские данные в пользу того, что встречаемость резистентных штаммов положительно коррелирует с объемом потребления антибиотиков в общей популяции [5]. В работе, посвященной исследованию эпидемиологии инфекции H. pylori у коренного населения Аляски, показано, что применение макролидов в анамнезе было статистически связано с повышенной частотой встречаемости резистентности H. pylori к кларитромицину. В обследованной группе 37% были заражены кларитромицин-резистентными H. pylori, и из этих пациентов 92% ранее получали лечение макролидами. Более того, наблюдался эффект зависимости от дозы: частота встречаемости резистентности к кларитромицину была тем выше, чем большее количество курсов лечения макролидами было в подгруппах обследованных. В этой популяции подобная связь была найдена между частотой резистентности к метронидазолу и объемом использования метронидазола в индивидуальной истории больных [17].
Кларитромицин
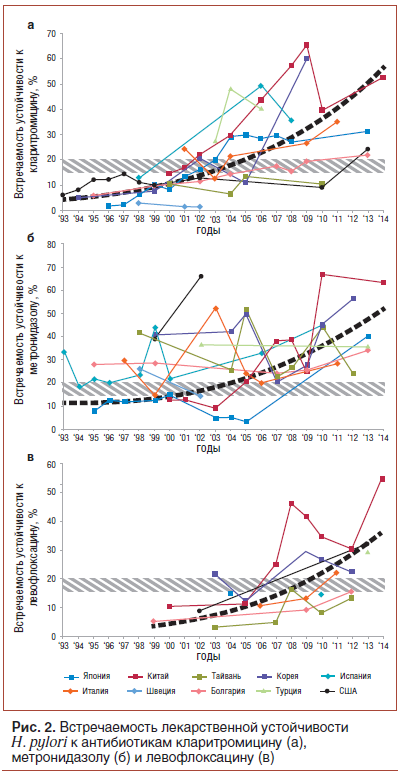
Распространенность устойчивости к кларитромицину увеличивается во многих странах (рис. 2а) [5, 18–23]. Исследования показали, что в странах, где низок общий уровень серопозитивности к маркерам инфекции H. pylori, распространенность антибиотикорезистентности не меняется со временем. Например, указанная серопозитивность в Швеции остается приблизительно постоянной (~20%) с 1995 г. Распространенность кларитромицин-резистентных штаммов в этой стране также остается низкой (менее 5%). Напротив, страны с высокой встречаемостью серологических маркеров H. pylori сталкиваются с ростом устойчивости возбудителяк кларитромицину. Например, распространенность устойчивости к кларитромицину значительно возросла (с 1,8% в 1996 г. до 27,1% в 2008 г.) в Японии; серопозитивность за период 2000–2013 гг. выросла с 40 до 55%, а встречаемость кларитромицин-резистентных случаев достигла 31,1%. Аналогично в Китае с 2000 по 2014 г. встречаемость резистентности H. pylori к кларитромицину выросла более чем в 3 раза (!) — с 14,8 до 52,6%; одновременно росла серопозитивность в общей популяции — с 65 до 83% [8, 9, 19]. В Корее встречаемость кларитромицин-резистентных случаев в период с 2005 по 2009 г. выросла еще больше — с 11 до 60%. У населения США в общей популяции распространенность устойчивости к кларитромицину возросла с 6,1% в 1993 г. до 12,9% в 2002 г. [15], в педиатрической популяции распространенность резистентности к кларитромицину значительно выше, чем в общей популяции, и достигает 50% [24].
Метронидазол
Во многих странах мира отмечена резистентность H.pylori к метронидазолу, и ее уровень растет (рис. 2б) [18–22, 25–28]. Распространенность резистентности H.pylori к метронидазолу в Европе в общей популяции варьирует на уровне от 20 до 40% со средней цифрой 33,1% без явных различий между Южной и Северной Европой. Зато в Центральной и Восточной Европе уровни резистентности ниже. С другой стороны, в развивающихся странах за пределами Европы резистентность H. pylori к метронидазолу встречается значительно чаще (50–80%), например в Мексике — 76,3%. В развитых странах за пределами Европы резистентность к метронидазолу в общей популяции встречается реже, чем средняя цифра по Европе: в Японии — 9–12%, в Канаде — 18–22%, в США — 21,5% [23]. Ряд авторов объясняет различия в частоте встречаемости резистентности неодинаковыми объемами предшествующего использования метронидазола в обследованных регионах. Обследование коренных народов Аляски показало статистически значимо бóльшую частоту встречаемости устойчивости среди женщин по сравнению с мужчинами, причем уровни резистентности коррелировали с количеством перенесенных курсов терапии метронидазолом.Другие антибиотики
Частота встречаемости устойчивости H. pylori к тетрациклину низкая: 0,7% в Испании, 0,5% в Великобритании, 0,5% в Гонконге, причем в ряде стран сообщили об отсутствии выявления случаев резистентности к тетрациклину [5]. Некоторые исследования определяли распространенность устойчивости к фторхинолонам [1].В Китае, Италии и США резистентность к левофлоксацину обнаружена в 34,5, 22,1 и 31,9% случаев соответственно [19, 21, 23]. Распространенность резистентности к левофлоксацину в Европе известна на примере Португалии — 20,9%. Эпидемиология резистентности к левофлоксацину изучена гораздо хуже, чем к другим упомянутым препаратам, однако ряд авторов указывает на тенденцию к увеличению встречаемости устойчивости H. pylori к левофлоксацину со временем (рис. 2в) [5, 19, 21–23, 25, 27, 28]. В Нидерландах обнаружено, что в 4,7% случаев выделенные штаммы H. pylori устойчивы к терапевтическим концентрациям нового антибиотика тровафлоксацина. Во Франции резистентность к фторхинолонам описана в 3,3% случаев, в странах Восточной Европы — в 3,9%. Также описано, что новый фторхинолоновый антибиотик ситафлоксацин, по-видимому, не обладает выраженной кросс-резистентностью с другими фторхинолонами (которые уже имеют историю использования в популяции) и поэтому эффективно эрадицирует H. pylori [29, 30].
Устойчивость H. pylori к амоксициллину в европейских странах встречается редко (от 0 до <2%) [31], но выявлена с существенной частотой (до 38%) в Азии и Южной Америке [32].
Диагностика инфекции H. pylori
Тестирование пациентов с болями в эпигастральной области и диспепсией на инфекцию H. pylori стало распространенной диагностической практикой. Важность хеликобактерной инфекции значительно возросла в связи с обнаружением статистической связи между данной инфекцией и раком желудка. Международное агентство по изучению рака (International Agency for Research on Cancer) считает H. pylori канцерогеном I группы [2].Способы обследования на инфекцию H. pylori делятся на инвазивные и неинвазивные. Неинвазивные методы рекомендованы для пациентов <55 лет, которые обращаются впервые с диспепсией, но без так называемых сигнальных симптомов. Эти тесты включают серологическое исследование; уреазный дыхательный тест с мочевиной, меченной изотопом углерода 13C; тест на антигены H. pylori в стуле пациента. Серологическое тестирование обнаруживает иммуноглобулины IgG к антигенам H. pylori в сыворотке; впрочем, есть и рекомендации не использовать серологический метод для диагностики данной инфекции из-за того, что уровень сероконверсии существенно ниже 100% [1]. Серологический тест не пригоден для мониторинга эффективности терапии, поскольку успешное лечение не изменяет уровня IgG в краткосрочной перспективе. Альтернативный серологический метод предусматривает обнаружение антител другого класса — IgM к антигенам H.pylori, которые появляются в период острой фазы инфекции сразу после заражения, однако период времени, в течение которого IgM присутствуют в определяемых концентрациях, слишком короткий.
Уреазный дыхательный тест с мочевиной, меченной 13C, в настоящее время является «золотым стандартом» для диагностирования инфекции H. pylori. Этот тест использует мочевину, в молекулу которой включен нерадиоактивный, но редкий изотоп углерода 13С, для выявления активности фермента уреазы (у человека нет эндогенной уреазы, но этот фермент производят многие бактерии, и в частности H. pylori). Наличие изотопа 13C в выдыхаемом воздухе статистически связано с инфекцией H. pylori. Еще один неинвазивный тест обнаруживает антиген H. pylori в стуле больного с помощью реакции с соответствующими антителами и последующей детекции образовавшихся комплексов антиген — антитело. Важное преимущество дыхательного теста с мочевиной и теста на антиген в стуле больного заключается в пригодности указанных методов для контроля полноты эрадикации патогена в результате лечения [33, 34].
Гастроэндоскопия (инвазивная процедура) рекомендована для пациентов с впервые выявленной диспепсией, сопровождаемой сигнальными симптомами, среди которых непреднамеренная потеря веса, желудочно-кишечные кровотечения, железодефицитная анемия или дисфагия. Для больных с впервые выявленной диспепсией в отсутствие сигнальных симптомов гастроэндоскопия показана, если возраст больного >54 лет (впрочем, граничный возраст, при котором следует назначать гастроэндоскопию, является предметом дискуссий и может варьировать в зависимости от популяционной группы, а именно от локальной частоты рака желудка в данной группе) [1]. Если при обследовании больного можно быстро получить биопсию, рекомендовано проведение быстрого уреазного теста. В быстром уреазном тесте исследуют биоптаты антрального отдела и тела желудка для обнаружения активности уреазы. Уреазный тест быстрее гистологического исследования, но на практике если есть возможность взять биопсию, то образец также отправляется на гистологическое исследование из-за его высокой диагностической ценности — оно позволяет оценить тяжесть воспаления и обнаружить присоединяющиеся патологии, в т. ч. лимфому или карциному желудка [7]. Для микроскопического выявления H.pylori в биопсиях предложены несколько методов окрашивания (например, модифицированный метод Гимза или окрашивание по Уортину — Старри, или иммуногистохимические методы).
Стратегии антибиотикотерапии
Для лечения инфекции H. pylori разработано много протоколов терапии (рис. 3). В том случае если не удается достигнуть эрадикации, предложены протоколы консервативного поддерживающего лечения.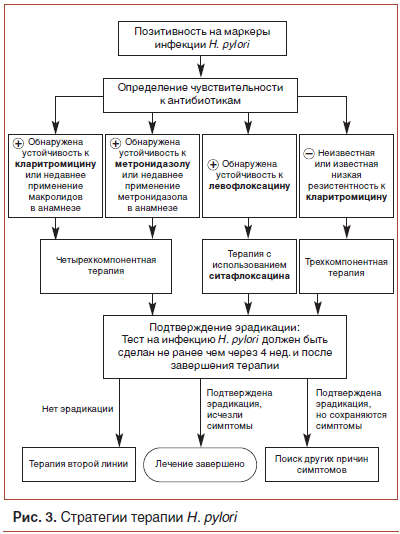
Тройная терапия
Эффективность применения антибиотиков зависит от ряда факторов, таких как эффективность антимикробного действия выбранного препарата с учетом возможной резистентности, способа применения, продолжительности курса. При назначении лечения также следует учитывать эффекты, определяющие приверженность больного протоколу лечения, которые связаны со стоимостью препарата, его побочными действиями и переносимостью. Внастоящее время стандартный протокол лечения инфекции H. pylori в регионах, где распространенность резистентности к кларитромицину ниже 15%, представляет собой тройную терапию, которая включает ингибиторы протонной помпы (ИПП), кларитромицин и амоксициллин [35]. Эта терапевтическая схема широко используется в мире уже более 10 лет, однако ее эффективность постепенно снижается. В случае аллергии к пенициллинам у больного амоксициллин можно заменить метронидазолом без потери эффективности тройной терапии. Основной причиной неудачи эрадикации для стандартного протокола тройной терапии считается повышенная устойчивость изолята H. pylori у больного к кларитромицину. Другие факторы, которые могут повлиять на показатели эффективности лечения, включают приверженность терапии (соблюдение пациентом назначений), повышенную массу тела, генотип H. pylori, уровень бактериальной нагрузки, кислотность желудочного сока и наличие у пациента атрофического гастрита. Некоторые авторы предлагают в регионах, где высока встречаемость резистентности к кларитромицину, избегать стандартного протокола (включающего кларитромицин) для проведения терапии первой линии [16, 36]. В соответствии с Маастрихтским консенсусом рекомендуется тестирование чувствительности до назначения лечения в регионах, где уровень резистентности превышает 20% в популяционной группе (например, выделенной по полу и возрасту), к которой относится пациент [1]. Кроме этого, рекомендовано учитывать индивидуальную историю применения макролидных антибиотиков, потому что такой анамнез повышает вероятность обнаружить устойчивость к кларитромицину [17].Европейские рекомендации предусматривают назначение тройной терапии с 7-дневным курсом в районах, где встречаемость устойчивости к кларитромицину <15%; эти же рекомендации предусматривают тройную терапию с 14-дневным курсом в районах, где встречаемость указанной резистентности >20% [1]. Рандомизированное исследование, проведенное Paoluzi et al., посвящено сравнению частоты эрадикации H. pylori в группах пациентов, получавших стандартную тройную терапию (амоксициллин, кларитромицин и омепразол) в течение 7 или 14 дней. Уровень резистентности в обеих группах в данном исследовании не определяли и не сравнивали, однако результаты показали, что 14-дневный курс приводит к лучшим результатам по эрадикации по сравнению с 7-дневным (77% против 66%).
4-компонентная терапия, включающая соли висмута
4-компонентная терапия включает ИПП, препараты висмута и 2 антибиотика (обычно 2 из следующего перечня: тетрациклин, кларитромицин и метронидазол) [1]. Эффективность данного протокола в качестве терапии первой линии была проверена в регионах с высоким уровнем резистентности к кларитромицину или метронидазолу, а также в группах пациентов с историей недавнего или многократного предшествующего лечения указанными антибиотиками [1]. Основным преимуществом этой схемы является то, что она позволяет преодолеть устойчивость к кларитромицину или метронидазолу, и с этой целью данный протокол предусматривает одновременное применение кларитромицина и метронидазола. Метаанализ, выполненный Fisch и Evans, показал лучшую эффективность 4-компонентной терапии по сравнению со стандартной тройной терапией в регионах с повышенной частотой встречаемости резистентности к кларитромицину или метронидазолу.Доксициклин или амоксициллин можно применять как замену для тетрациклина и солей висмута в регионах, где последние препараты недоступны. Однако данные об эффективности такой замены неоднозначны [37]. При назначении 4-компонентной терапии следует учитывать пониженную приверженность лечению у пациентов в связи с увеличением количества наименований препаратов и более частым приемом.
Последовательная терапия
Последовательная терапия была впервые проведена по протоколу, описанному Zullo et al., она состоит из 10-дневного лечения, включающего 5 дней комбинации ИПП + амоксициллин, затем 5 дней тройной терапии сочетанием ИПП + кларитромицин + метронидазол [1]. Левофлоксацин может быть использован у пациентов с аллергией на пенициллины или в районах с высоким уровнем резистентности к кларитромицину. Хотя последовательная терапия включает кларитромицин, она считается альтернативой стандартной тройной терапии, пригодной для использования в местностях с высокой встречаемостью устойчивости к кларитромицину [1]. Этот терапевтический режим использует назначение амоксициллина перед применением кларитромицина с целью преодоления устойчивости к кларитромицину. Амоксициллин разрушает клеточные стенки H. pylori и препятствует работе мембранных каналов экспорта кларитромицина из бактериальной клетки (один из механизмов устойчивости данной бактерии). Недостатком этой схемы терапии является ее сложность в отношении режима приема препаратов, которая снижает приверженность [16]. Если пациент не соблюдает протокол лечения, есть вероятность развития множественной лекарственной устойчивости. Последовательная терапия использует основные антибиотики, эффективные против H. pylori, и это означает, что неуспех последовательной терапии ограничивает возможности терапии второй линии.Сопутствующая терапия
Сопутствующая терапия представляет собой назначение курса лечения с использованием ИПП, кларитромицина, амоксициллина и метронидазола в течение по крайней мере 10 дней. В рандомизированных клинических испытаниях сопутствующая терапия превзошла по эффективности стандартную тройную терапию [38]. Метаанализ данных, полученных в Японии, Великобритании, Германии, Испании и Италии, показал уровень эрадикации >90%. Исследование в Тайване сравнило эффективность сопутствующей терапии и последовательной терапии с эффективностью использования одного и того же сочетания препаратов: ИПП, левофлоксацина, амоксициллина и метронидазола. Распространенность резистентности в группе больных до начала лечения была следующей: резистентность к левофлоксацину — 10,2%, к амоксициллину — 0,6%, к кларитромицину — 6,6% и к метронидазолу — 33,5%. Эффективность эрадикации с использованием 2-х терапевтических схем оказалась сравнимой: 92,2% для сопутствующей терапии и 93,3% для последовательной терапии [39].Теоретически преимуществом сопутствующей терапии может быть эффективность против штаммов с множественной лекарственной устойчивостью [40], однако на практике встречаемость даже двойной устойчивости (устойчивости клинических изолятов H. pylori одновременно к 2 антибиотикам разных классов) не изучена.
Гибридная терапия (последовательно-сопутствующая)
В одной из работ предложена гибридная терапевтическая схема, которая представляет собой комбинацию ступенчатой и сопутствующей терапии [41]. Гибридная схема включает первоначальный курс ИПП + амоксициллин в течение 7 дней, после которого назначается 4-компонентная терапия сочетанием ИПП, амоксициллина, метронидазола и кларитромицина в течение 7 дней. Частота эрадикации была отличная — 99% (!), причем отмечена эрадикация штаммов с двойной устойчивостью (к кларитромицину и метронидазолу) [42]. Авторы указанного исследования предполагают, что высокая эффективность гибридной терапии связана с более длительным приемом амоксициллина (в течение 14 дней) по сравнению с последовательной или сопутствующей терапевтическими схемами. Действительно, одно рандомизированное клиническое испытание показало, что гибридная терапия эквивалентна по уровням эрадикации удлиненному (14-дневному) курсу сопутствующей терапии [43].Терапия второй линии на основе хинолонов
В случаях, когда не удается эрадицировать H. pylori с использованием стандартной тройной терапии, предложено использовать терапию второй линии (salvage therapy): ИПП + левофлоксацин + амоксициллин в течение 10 дней [44]. Ряд исследований в Европе и Тайване продемонстрировал варьирующие конечные (после прохождения терапии первой и второй линии) уровни эрадикации (65–96%) что, вероятно, отражает различную встречаемость устойчивости к левофлоксацину в разных географических регионах [44].Другой режим терапии второй линии (так называемый LOAD (от Levofloxacin, Omeprazole, Nitazoxanide, Doxycycline)) включает прием комбинации левофлоксацина, омепразола, нитазоксанида и доксициклина в течение 7 или 10 дней. Исследование эффективности лечения когорты из 653 пациентов показало, что применение схемы LOAD привело к более высоким конечным уровням эрадикации (90%) по сравнению с таковым при применении стандартной тройной терапии (73%), независимо от продолжительности курса [45]. Кроме этого, данное исследование показало, что у пациентов на фоне LOAD-терапии статистически значимо реже наблюдались рецидивы в течение 1-летнего периода наблюдения [45].
Терапия третьей линии: левофлоксацин, рифабутин, фуразолидон
Для пациентов, у которых не произошло эрадикации возбудителя после курсов терапии первой и второй линии, предлагается использование левофлоксацина. В одном исследовании в качестве терапии третьей линии предложено использование левофлоксацина в сочетании с рабепразолом, субцитратом висмута и амоксициллином. В данном исследовании, несмотря на наличие множественной лекарственной устойчивости, 10-дневный курс лечения привел к конечному уровню эрадикации в 84%. При этом в подгруппе пациентов, у которых была обнаружена резистентность возбудителя к амоксициллину или левофлоксацину, конечный уровень эрадикации был ниже.Выбор терапии с использованием хинолонов должен быть основан на результатах испытаний антибиотикочувствительности или хотя бы на данных о встречаемости резистентности в данном географическом регионе. Частота встречаемости резистентности к хинолонам возрастает по мере роста использования хинолонов для лечения инфекций дыхательных и мочеполовых путей [1]. Таким образом, описанный режим лечения на основе хинолонов не рекомендуется в качестве первой линии терапии. Иногда этот режим используется в качестве терапии второй линии в популяциях, где уровень устойчивости к кларитромицину >15–20%, к хинолонам <10%.
Терапия на основе рифабутина
На основании результатов исследований in vitro была предложена стратегия терапии на основе рифабутина (антибиотик, изначально нашедший терапевтическое применение для лечения туберкулеза), которая включает курс сочетанием ИПП + амоксициллин + рифабутин. Оптимальная продолжительность лечения по указанному протоколу не ясна (предложены курсы 7, 10 или 14 дней). Важным, но не частым осложнением при применении рифабутина является миелотоксичность [46]. В связи с потенциалом развития резистентности к рифабутину у возбудителя туберкулеза, циркулирующего в человеческой популяции, применение рифабутина не должно быть рутинным, вышеуказанная терапевтическая схема предложена только как терапия третьей линии. Кроме того, данная терапевтическая схема рекомендована для использования в случаях, когда невозможно использовать соли висмута и тетрациклин [1, 46].Терапия на основе фуразолидона
Схема с применением фуразолидона включает недельный курс терапии сочетанием лансопразола, висмута трикалия дицитрата, тетрациклина и фуразолидона. Данная схема используется в случае неуспеха терапии второй линии. Конечная эффективность эрадикации достигает 90%. Проблемами, возникающими при применении этой схемы, являются высокая частота побочных эффектов и влияние существующей в популяции патогена перекрестной резистентности с метронидазолом.Двухкомпонентная терапия высокими дозами
Двухкомпонентная терапия высокими дозами была использована в регионах с высокой частотой встречаемости резистентности к кларитромицину. Эта схема включает применение ИПП и амоксициллина 3 р./сут в течение 14 дней [47]. Уровень эрадикации составил 78,4%, что несущественно ниже эффективности стандартной тройной терапии.Заключение
Инфекция H. pylori повсеместно распространена в мире, однако встречаемость устойчивости к антибиотикам у изолятов H. pylori сильно варьирует между географическими регионами и, по имеющимся данным, имеет тенденцию к росту. Во многих странах встречаемость устойчивости H. pylori к антибиотикам перешагнула порог в 15–20%. В течение последних 20 лет эффективность эрадикации в ходе терапии упала ниже уровня 80–90%. Важнейшими причинами неуспеха терапии являются устойчивость к антибиотикам и несоблюдение режима приема препаратов из-за недостаточной приверженности пациентов лечению. Распространение резистентности у микроорганизмов коррелирует с объемом потребления антибиотиков, что показано и на примере хеликобактерной инфекции. С течением времени растет необходимость определения антибиотикорезистентности перед назначением терапии. По всей видимости, в будущем следует ожидать изменения парадигмы терапии — перехода от стандартной схемы лечения к индивидуально подобранной терапии.
Литература
1. Malfertheiner P., Megraud F., O’Morain C.A. et al. Management of Helicobacter pylori infection-the Maastricht IV/Florence consensus report // Gut. 2012. Vol. 61. P.646–664.
2. Dinis-Ribeiro M., Areia M., de Vries A.C. et al. Management of precancerous conditions and lesions in the stomach (MAPS): guideline from the European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter Study Group (EHSG), European Society of Pathology (ESP), and the Sociedade Portuguesa // Endoscopy. 2012. Vol.44. P. 74–94.
3. Banic M., Franceschi F., Babic Z., Gasbarrini A. Extragastric manifestations of Helicobacter pylori infection // Helicobacter. 2012. Vol. 17. P. 49–55.
4. Chen B-F., Xu X., Deng Y. et al. Relationship between Helicobacter pylori infection and serum interleukin- 18 in patients with carotid atherosclerosis // Helicobacter. 2013. Vol.18. P. 124–128.
5. Megraud F., Coenen S., Versporten A. et al. Helicobacter pylori resistance to antibiotics in Europe and its relationship to antibiotic consumption // Gut. 2013. Vol. 62. P.34–42.
6. Selgrad M., Malfertheiner P. Treatment of Helicobacter pylori // Curr. Opin. Gastroenterol. 2011. Vol. 27. P. 565–570.
7. Sugano K., Tack J., Kuipers E.J., et al. Kyoto global consensus report on Helicobacter pylori gastritis // Gut. 2015. Vol. 64. P. 1353-1367.
8. Zhang M., Zhou Y-Z., Li X-Y. et al. Seroepidemiology of Helicobacter pylori infection in elderly people in the Beijing region, China // World J. Gastroenterol. 2014. Vol. 20. P.3635–3639.
9. Rahman R., Asombang A.W., Ibdah J.A. Characteristics of gastric cancer in Asia // World J. Gastroenterol. 2014. Vol. 20. P. 4483–4490.
10. Lim S.H., Kwon J-W., Kim N. et al. Prevalence and risk factors of Helicobacter pylori infection in Korea: nationwide multicenter study over 13 years // BMC Gastroenterol. 2013. Vol. 13. P. 104.
11. Ierardi E., Giorgio F., Losurdo G. et al. How antibiotic resistances could change Helicobacter pylori treatment: a matter of geography? // World J. Gastroenterol. 2013. Vol.19. P. 8168–8180.
12. Ozaydin N., Turkyilmaz S.A., Cali S. Prevalence and risk factors of Helicobacter pylori in Turkey: a nationally-representative, cross-sectional, screening with the 13C-Urea breath test // BMC Public Health. 2013. Vol. 13. P. 1215.
13. Grad Y.H., Lipsitch M., Aiello A.E. Secular trends in Helicobacter pylori seroprevalence in adults in the United States: evidence for sustained race/ethnic disparities // Am. J. Epidemiol. 2012. Vol. 175. P. 54–59.
14. Chen Y., Blaser M.J. Association between gastric Helicobacter pylori colonization and glycated hemoglobin levels // J. Infect. Dis. 2012. Vol. 205. P. 1195–1202.
15. Graham D.Y. Helicobacter pylori update: gastric cancer, reliable therapy, and possible benefits // Gastroenterology. 2015. Vol. 148. P. 719–731.
16. Graham D.Y., Shiotani A. Which therapy for Helicobacter pylori infection? // Gastroenterology. 2012. Vol. 143. P. 10–12.
17. McNulty C.A.M., Lasseter G., Shaw I. et al. Is Helicobacter pylori antibiotic resistance surveillance needed and how can it be delivered? // Aliment. Pharmacol. Ther. 2012. Vol.35. P. 1221–1230.
18. Okamura T., Suga T., Nagaya T. et al. Antimicrobial resistance and characteristics of eradication therapy of Helicobacter pylori in Japan: a multi-generational comparison // Helicobacter. 2014. Vol. 19. P. 214–220.
19. Zhang Y-X., Zhou L-Y., Song Z-Q. et al. Primary antibiotic resistance of Helicobacter pylori strains isolated from patients with dyspeptic symptoms in Beijing: a prospective serial study // World J. Gastroenterol. 2015. Vol. 21. P. 2786–2792.
20. Tsay F-W., Wu D-C., Kao S-S. et al. Reverse sequential therapy achieves a similar eradication rate as standard sequential therapy for Helicobacter pylori eradication: a randomized controlled trial // Helicobacter. 2015. Vol. 20. P. 71–77.
21. Saracino I.M., Zullo A., Holton J. et al. High prevalence of primary antibiotic resistance in Helicobacter pylori isolates in Italy // J. Gastrointestin. Liver. Dis. 2012. Vol. 21. P.363–365.
22. Boyanova L., Davidkov L., Gergova G. et al. Helicobacter pylori susceptibility to fosfomycin, rifampin, and 5 usual antibiotics for H. pylori eradication // Diagn. Microbiol. Infect. Dis. 2014. Vol. 79. P. 358–361.
23. Shiota S., Reddy R., Alsarraj A. et al. Antibiotic resistance of Helicobacter pylori among male United States Veterans // Clin. Gastroenterol. Hepatol. 2015. Vol. 13. P.1616–1624.
24. Mitui M., Patel A., Leos N.K. et al. Novel Helicobacter pylori sequencing test identifies high rate of clarithromycin resistance // J. Pediatr. Gastroenterol. Nutr. 2014. Vol.59. P. 6–9.
25. An B., Moon B.S., Kim H. et al. Antibiotic resistance in Helicobacter pylori strains and its effect on H. pylori eradication rates in a single center in Korea // Ann. Lab. Med. 2013. Vol. 33. P. 415.
26. Chung J.W., Lee G.H., Jeong J.Y. et al. Resistance of Helicobacter pylori strains to antibiotics in Korea with a focus on fluoroquinolon // J. Gastroenterol. Hepatol. 2012. Vol. 27(3). P. 493–497. doi: 10.1111/j.1440-1746.2011.06874.x
27. Liou J.M., Chang C.Y., Chen M.J. et al. The primary resistance of Helicobacter pylori in Taiwan after the National Policy to Restrict Antibiotic Consumption and Its Relation to Virulence Factors. A Nationwide Study // PLoS ONE. 2015. Vol. 10(5): e0124199. doi: 10.1371/journal.pone.0124199. eCollection 2015.
28. Caliskan R., Tokman H.B., Erzin Y. et al. Antimicrobial resistance of Helicobacter pylori strains to five antibiotics, including levofloxacin, in Northwestern Turkey // Rev. Soc. Bras. Med. Trop. 2015. Vol. 48. P.278‒284.
29. Sugimoto M., Sahara S., Ichikawa H. et al. High Helicobacter pylori cure rate with sitafloxacin-based triple therapy // Aliment. Pharmacol. Ther. 2015. Vol. 42. P.477‒483.
30. Song M., Ang T.L. Second and third line treatment options for Helicobacter pylori eradication // World J. Gastroenterol. 2014. Vol. 20. P.1517‒1528.
31. Selgrad M., Tammer I., Langner C. et al. Different antibiotic susceptibility between antrum and corpus of the stomach, a possible reason for treatment failure of Helicobacter pylori infection // World J. Gastroenterol. 2014. Vol. 20. P.16245‒16251.
32. Yoon K.H., Park S.W., Lee S.W. et al. Clarithromycin-based standard triple therapy can still be effective for Helicobacter pylori eradication in some parts of the Korea // J. Korean Med. Sci. 2014. Vol. 29. P.1240‒1246.
33. Yaxley J., Chakravarty B. Helicobacter pylori eradication — an update on the latest therapies // Aust. Fam. Physician. 2014. Vol. 43. P.301‒305.
34. Lopes A.I., Vale F.F., Oleastro M. Helicobacter pylori infection — recent developments in diagnosis // World J. Gastroenterol. 2014. Vol. 20. P.9299‒9313.
35. Bang C.S., Baik G.H. Attempts to enhance the eradication rate of Helicobacter pylori infection // World J. Gastroenterol. 2014. Vol. 20. P.5252‒5262.
36. Graham D.Y., Lee Y.C., Wu M.S. Rational Helicobacter pylori therapy: evidence-based medicine rather than medicine-based evidence // Clin. Gastroenterol. Hepatol. 2014. Vol. 12. P.177‒186.
37. Wang Z., Wu S. Doxycycline-based quadruple regimen versus routine quadruple regimen for rescue eradication of Helicobacter pylori: an open-label control study in Chinese patients // Singapore Med. J. 2012. Vol. 53. P.273‒276.
38. Georgopoulos S., Papastergiou V., Xirouchakis E. et al. Nonbismuth quadruple “concomitant” therapy versus standard triple therapy, both of the duration of 10 days, for first- line H. pylori eradication: a randomized trial // J. Clin. Gastroenterol. 2013. Vol. 47. P.228‒232.
39. Federico A., Nardone G., Gravina A.G. et al. Efficacy of 5-day levofloxacin- containing concomitant therapy in eradication of Helicobacter pylori infection // Gastroenterology. 2012. Vol. 143. P.55‒61.
40. Kongchayanun C., Vilaichone R., Pornthisarn B. et al. Pilot studies to identify the optimum duration of concomitant Helicobacter pylori eradication therapy in Thailand // Helicobacter. 2012. Vol. 17. P.282‒285.
41. Hsu P.I., Wu D.C., Wu J.Y., Graham D.Y. Modified sequential Helicobacter pylori therapy: proton pump inhibitor and amoxicillin for 14 days with clarithromycin and metronidazole added as a quadruple (hybrid) therapy for the final 7 days // Helicobacter. 2011. Vol. 16. P.139‒145.
42. Molina-Infante J., Romano M., Fernandez-Bermejo M. et al. 14-day, high-dose acid suppression, non-bismuth quadruple therapies (“hybrid” vs. “concomitant”) for Helicobacter pylori infection: a randomized trial // Gut. 2012. Vol. 61(Suppl. 3). P.47.
43. Molina-Infante J., Romano M., Fernandez-Bermejo M. et al. Optimized nonbismuth quadruple therapies cure most patients with Helicobacter pylori infection in populations with high rates of antibiotic resistance // Gastroenterology. 2013. Vol. 145. P.121‒128.
44. Berning M., Krasz S., Miehlke S. Should quinolones come first in Helicobacter pylori therapy? // Therap. Adv. Gastroenterol. 2011. Vol. 4. P.103‒114.
45. Basu P.P., Rayapudi K., Pacana T. et al. A randomized study comparing levofloxacin, omeprazole, nitazoxanide, and doxycycline versus triple therapy for the eradication of Helicobacter pylori // Am. J. Gastroenterol. 2011. Vol. 106. P. 1970‒1975.
46. Gisbert J.P., Calvet X. Review article: rifabutin in the treatment of refractory Helicobacter pylori infection // Aliment. Pharmacol. Ther. 2012. Vol. 35. P.209‒221.
47. Kim S.Y., Jung S.W., Kim J.H. et al. Effectiveness of three times daily lansoprazole/amoxicillin dual therapy for Helicobacter pylori infection in Korea // Br. J. Clin. Pharmacol. 2012. Vol. 73. P.140‒143.
2. Dinis-Ribeiro M., Areia M., de Vries A.C. et al. Management of precancerous conditions and lesions in the stomach (MAPS): guideline from the European Society of Gastrointestinal Endoscopy (ESGE), European Helicobacter Study Group (EHSG), European Society of Pathology (ESP), and the Sociedade Portuguesa // Endoscopy. 2012. Vol.44. P. 74–94.
3. Banic M., Franceschi F., Babic Z., Gasbarrini A. Extragastric manifestations of Helicobacter pylori infection // Helicobacter. 2012. Vol. 17. P. 49–55.
4. Chen B-F., Xu X., Deng Y. et al. Relationship between Helicobacter pylori infection and serum interleukin- 18 in patients with carotid atherosclerosis // Helicobacter. 2013. Vol.18. P. 124–128.
5. Megraud F., Coenen S., Versporten A. et al. Helicobacter pylori resistance to antibiotics in Europe and its relationship to antibiotic consumption // Gut. 2013. Vol. 62. P.34–42.
6. Selgrad M., Malfertheiner P. Treatment of Helicobacter pylori // Curr. Opin. Gastroenterol. 2011. Vol. 27. P. 565–570.
7. Sugano K., Tack J., Kuipers E.J., et al. Kyoto global consensus report on Helicobacter pylori gastritis // Gut. 2015. Vol. 64. P. 1353-1367.
8. Zhang M., Zhou Y-Z., Li X-Y. et al. Seroepidemiology of Helicobacter pylori infection in elderly people in the Beijing region, China // World J. Gastroenterol. 2014. Vol. 20. P.3635–3639.
9. Rahman R., Asombang A.W., Ibdah J.A. Characteristics of gastric cancer in Asia // World J. Gastroenterol. 2014. Vol. 20. P. 4483–4490.
10. Lim S.H., Kwon J-W., Kim N. et al. Prevalence and risk factors of Helicobacter pylori infection in Korea: nationwide multicenter study over 13 years // BMC Gastroenterol. 2013. Vol. 13. P. 104.
11. Ierardi E., Giorgio F., Losurdo G. et al. How antibiotic resistances could change Helicobacter pylori treatment: a matter of geography? // World J. Gastroenterol. 2013. Vol.19. P. 8168–8180.
12. Ozaydin N., Turkyilmaz S.A., Cali S. Prevalence and risk factors of Helicobacter pylori in Turkey: a nationally-representative, cross-sectional, screening with the 13C-Urea breath test // BMC Public Health. 2013. Vol. 13. P. 1215.
13. Grad Y.H., Lipsitch M., Aiello A.E. Secular trends in Helicobacter pylori seroprevalence in adults in the United States: evidence for sustained race/ethnic disparities // Am. J. Epidemiol. 2012. Vol. 175. P. 54–59.
14. Chen Y., Blaser M.J. Association between gastric Helicobacter pylori colonization and glycated hemoglobin levels // J. Infect. Dis. 2012. Vol. 205. P. 1195–1202.
15. Graham D.Y. Helicobacter pylori update: gastric cancer, reliable therapy, and possible benefits // Gastroenterology. 2015. Vol. 148. P. 719–731.
16. Graham D.Y., Shiotani A. Which therapy for Helicobacter pylori infection? // Gastroenterology. 2012. Vol. 143. P. 10–12.
17. McNulty C.A.M., Lasseter G., Shaw I. et al. Is Helicobacter pylori antibiotic resistance surveillance needed and how can it be delivered? // Aliment. Pharmacol. Ther. 2012. Vol.35. P. 1221–1230.
18. Okamura T., Suga T., Nagaya T. et al. Antimicrobial resistance and characteristics of eradication therapy of Helicobacter pylori in Japan: a multi-generational comparison // Helicobacter. 2014. Vol. 19. P. 214–220.
19. Zhang Y-X., Zhou L-Y., Song Z-Q. et al. Primary antibiotic resistance of Helicobacter pylori strains isolated from patients with dyspeptic symptoms in Beijing: a prospective serial study // World J. Gastroenterol. 2015. Vol. 21. P. 2786–2792.
20. Tsay F-W., Wu D-C., Kao S-S. et al. Reverse sequential therapy achieves a similar eradication rate as standard sequential therapy for Helicobacter pylori eradication: a randomized controlled trial // Helicobacter. 2015. Vol. 20. P. 71–77.
21. Saracino I.M., Zullo A., Holton J. et al. High prevalence of primary antibiotic resistance in Helicobacter pylori isolates in Italy // J. Gastrointestin. Liver. Dis. 2012. Vol. 21. P.363–365.
22. Boyanova L., Davidkov L., Gergova G. et al. Helicobacter pylori susceptibility to fosfomycin, rifampin, and 5 usual antibiotics for H. pylori eradication // Diagn. Microbiol. Infect. Dis. 2014. Vol. 79. P. 358–361.
23. Shiota S., Reddy R., Alsarraj A. et al. Antibiotic resistance of Helicobacter pylori among male United States Veterans // Clin. Gastroenterol. Hepatol. 2015. Vol. 13. P.1616–1624.
24. Mitui M., Patel A., Leos N.K. et al. Novel Helicobacter pylori sequencing test identifies high rate of clarithromycin resistance // J. Pediatr. Gastroenterol. Nutr. 2014. Vol.59. P. 6–9.
25. An B., Moon B.S., Kim H. et al. Antibiotic resistance in Helicobacter pylori strains and its effect on H. pylori eradication rates in a single center in Korea // Ann. Lab. Med. 2013. Vol. 33. P. 415.
26. Chung J.W., Lee G.H., Jeong J.Y. et al. Resistance of Helicobacter pylori strains to antibiotics in Korea with a focus on fluoroquinolon // J. Gastroenterol. Hepatol. 2012. Vol. 27(3). P. 493–497. doi: 10.1111/j.1440-1746.2011.06874.x
27. Liou J.M., Chang C.Y., Chen M.J. et al. The primary resistance of Helicobacter pylori in Taiwan after the National Policy to Restrict Antibiotic Consumption and Its Relation to Virulence Factors. A Nationwide Study // PLoS ONE. 2015. Vol. 10(5): e0124199. doi: 10.1371/journal.pone.0124199. eCollection 2015.
28. Caliskan R., Tokman H.B., Erzin Y. et al. Antimicrobial resistance of Helicobacter pylori strains to five antibiotics, including levofloxacin, in Northwestern Turkey // Rev. Soc. Bras. Med. Trop. 2015. Vol. 48. P.278‒284.
29. Sugimoto M., Sahara S., Ichikawa H. et al. High Helicobacter pylori cure rate with sitafloxacin-based triple therapy // Aliment. Pharmacol. Ther. 2015. Vol. 42. P.477‒483.
30. Song M., Ang T.L. Second and third line treatment options for Helicobacter pylori eradication // World J. Gastroenterol. 2014. Vol. 20. P.1517‒1528.
31. Selgrad M., Tammer I., Langner C. et al. Different antibiotic susceptibility between antrum and corpus of the stomach, a possible reason for treatment failure of Helicobacter pylori infection // World J. Gastroenterol. 2014. Vol. 20. P.16245‒16251.
32. Yoon K.H., Park S.W., Lee S.W. et al. Clarithromycin-based standard triple therapy can still be effective for Helicobacter pylori eradication in some parts of the Korea // J. Korean Med. Sci. 2014. Vol. 29. P.1240‒1246.
33. Yaxley J., Chakravarty B. Helicobacter pylori eradication — an update on the latest therapies // Aust. Fam. Physician. 2014. Vol. 43. P.301‒305.
34. Lopes A.I., Vale F.F., Oleastro M. Helicobacter pylori infection — recent developments in diagnosis // World J. Gastroenterol. 2014. Vol. 20. P.9299‒9313.
35. Bang C.S., Baik G.H. Attempts to enhance the eradication rate of Helicobacter pylori infection // World J. Gastroenterol. 2014. Vol. 20. P.5252‒5262.
36. Graham D.Y., Lee Y.C., Wu M.S. Rational Helicobacter pylori therapy: evidence-based medicine rather than medicine-based evidence // Clin. Gastroenterol. Hepatol. 2014. Vol. 12. P.177‒186.
37. Wang Z., Wu S. Doxycycline-based quadruple regimen versus routine quadruple regimen for rescue eradication of Helicobacter pylori: an open-label control study in Chinese patients // Singapore Med. J. 2012. Vol. 53. P.273‒276.
38. Georgopoulos S., Papastergiou V., Xirouchakis E. et al. Nonbismuth quadruple “concomitant” therapy versus standard triple therapy, both of the duration of 10 days, for first- line H. pylori eradication: a randomized trial // J. Clin. Gastroenterol. 2013. Vol. 47. P.228‒232.
39. Federico A., Nardone G., Gravina A.G. et al. Efficacy of 5-day levofloxacin- containing concomitant therapy in eradication of Helicobacter pylori infection // Gastroenterology. 2012. Vol. 143. P.55‒61.
40. Kongchayanun C., Vilaichone R., Pornthisarn B. et al. Pilot studies to identify the optimum duration of concomitant Helicobacter pylori eradication therapy in Thailand // Helicobacter. 2012. Vol. 17. P.282‒285.
41. Hsu P.I., Wu D.C., Wu J.Y., Graham D.Y. Modified sequential Helicobacter pylori therapy: proton pump inhibitor and amoxicillin for 14 days with clarithromycin and metronidazole added as a quadruple (hybrid) therapy for the final 7 days // Helicobacter. 2011. Vol. 16. P.139‒145.
42. Molina-Infante J., Romano M., Fernandez-Bermejo M. et al. 14-day, high-dose acid suppression, non-bismuth quadruple therapies (“hybrid” vs. “concomitant”) for Helicobacter pylori infection: a randomized trial // Gut. 2012. Vol. 61(Suppl. 3). P.47.
43. Molina-Infante J., Romano M., Fernandez-Bermejo M. et al. Optimized nonbismuth quadruple therapies cure most patients with Helicobacter pylori infection in populations with high rates of antibiotic resistance // Gastroenterology. 2013. Vol. 145. P.121‒128.
44. Berning M., Krasz S., Miehlke S. Should quinolones come first in Helicobacter pylori therapy? // Therap. Adv. Gastroenterol. 2011. Vol. 4. P.103‒114.
45. Basu P.P., Rayapudi K., Pacana T. et al. A randomized study comparing levofloxacin, omeprazole, nitazoxanide, and doxycycline versus triple therapy for the eradication of Helicobacter pylori // Am. J. Gastroenterol. 2011. Vol. 106. P. 1970‒1975.
46. Gisbert J.P., Calvet X. Review article: rifabutin in the treatment of refractory Helicobacter pylori infection // Aliment. Pharmacol. Ther. 2012. Vol. 35. P.209‒221.
47. Kim S.Y., Jung S.W., Kim J.H. et al. Effectiveness of three times daily lansoprazole/amoxicillin dual therapy for Helicobacter pylori infection in Korea // Br. J. Clin. Pharmacol. 2012. Vol. 73. P.140‒143.

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья

