Эффективность и безопасность ингаляционных глюкокортикостероидов у больных бронхиальной астмой (лекция)
РМЖ. №3(I) от 30.03.2018 стр. 20-25
Рубрика:
Болезни дыхательных путей
В статье рассматриваются клиническая фармакология ингаляционных глюкокортикостероидов (ИГКС), механизмы их действия, эффективность и особенности клинического применения у больных бронхиальной астмой (БА). Эти препараты показаны при БА различной степени тяжести у взрослых и детей. При легком течении БА они используются в виде монотерапии, а при среднетяжелой и тяжелой БА — в виде комбинации с b2-адреномиметиками длительного действия, антилейкотриеновыми препаратами и длительно действующими теофиллинами. Рассматриваются режимы дозирования комбинации ИГКС и b2-адреномиметиков длительного действия. Приводятся рекомендации по снижению доз стероидов при достижении контроля астмы. При назначении ИГКС необходимо учитывать соотношение их эффективности и безопасности. Приводятся данные о возможных побочных эффектах, факторах, влияющих на их развитие, и методах профилактики. Обсуждаются перспективы клинического применения ИГКС у больных БА легкого течения.
Ключевые слова: ингаляционные глюкокортикостероиды, эффективность, безопасность, бронхиальная астма.
Для цитирования: Емельянов А.В. Эффективность и безопасность ингаляционных глюкокортикостероидов у больных бронхиальной астмой (лекция). РМЖ. Медицинское обозрение. 2018;26(3(I)):20-25.
Ключевые слова: ингаляционные глюкокортикостероиды, эффективность, безопасность, бронхиальная астма.
Для цитирования: Емельянов А.В. Эффективность и безопасность ингаляционных глюкокортикостероидов у больных бронхиальной астмой (лекция). РМЖ. Медицинское обозрение. 2018;26(3(I)):20-25.
Efficacy and safety of inhaled glucocorticosteroids in patients with bronchial asthma (lecture)
Emelyanov A.V.
North-western State Medical University named after I.I.Mechnikov, St.Petersburg
The review is focused on the clinical pharmacology of inhaled glucocorticosteroids (IGCS), mechanisms of their action, efficacy and peculiarities of clinical use in patients with asthma. These drugs are indicated for the treatment of asthma of varying severity in adults and children. They are used as a monotherapy in mild asthma, for the treatment of moderate and severe asthma they are used in a combination with long-acting b2-agonists, antileukotriens and long-acting theophyllines. Dosage regimens for the combination of IGCS and long-acting b2-agonists are considered. The article provides recommendations for reducing steroid doses when asthma control is achieved. The ratio risk/benefit has to be considered when appointing IGCS. Data on possible side effects, factors affecting their development and methods of prevention are given. The prospects of clinical use of IGCS in patients with mild asthma are considered.
Key words: inhaled glucocorticosteroids, efficacy, safety, asthma.
For citation: Emelyanov A.V. Efficacy and safety of inhaled glucocorticosteroids in patients with bronchial asthma (lecture) // RMJ. 2018. № 3(I). P. 20–25.
Emelyanov A.V.
North-western State Medical University named after I.I.Mechnikov, St.Petersburg
The review is focused on the clinical pharmacology of inhaled glucocorticosteroids (IGCS), mechanisms of their action, efficacy and peculiarities of clinical use in patients with asthma. These drugs are indicated for the treatment of asthma of varying severity in adults and children. They are used as a monotherapy in mild asthma, for the treatment of moderate and severe asthma they are used in a combination with long-acting b2-agonists, antileukotriens and long-acting theophyllines. Dosage regimens for the combination of IGCS and long-acting b2-agonists are considered. The article provides recommendations for reducing steroid doses when asthma control is achieved. The ratio risk/benefit has to be considered when appointing IGCS. Data on possible side effects, factors affecting their development and methods of prevention are given. The prospects of clinical use of IGCS in patients with mild asthma are considered.
Key words: inhaled glucocorticosteroids, efficacy, safety, asthma.
For citation: Emelyanov A.V. Efficacy and safety of inhaled glucocorticosteroids in patients with bronchial asthma (lecture) // RMJ. 2018. № 3(I). P. 20–25.
В лекции рассматриваются клиническая фармакология ингаляционных глюкокортикостероидов, механизмы их действия, эффективность и особенности клинического применения у больных бронхиальной астмой.
 Ингаляционные глюкокортикостероиды (ИГКС) используются в клинической практике с 1972 г. Они играют важную роль в лечении бронхиальной астмы (БА). По сравнению с системными глюкокортикостероидами (ГКС) ИГКС имеют высокое сродство к рецепторам дыхательных путей, меньшую биодоступность и применяются в пониженных дозах. Эти особенности определяют их высокую эффективность при минимальной системной активности.
Ингаляционные глюкокортикостероиды (ИГКС) используются в клинической практике с 1972 г. Они играют важную роль в лечении бронхиальной астмы (БА). По сравнению с системными глюкокортикостероидами (ГКС) ИГКС имеют высокое сродство к рецепторам дыхательных путей, меньшую биодоступность и применяются в пониженных дозах. Эти особенности определяют их высокую эффективность при минимальной системной активности.
Механизм действия ИГКС
Механизм действия ИГКС изучен недостаточно [1]. Предполагается, что эти препараты путем диффузии проникают в цитоплазму клетки и взаимодействуют с цитозольными (a-) рецепторами, которые в неактивном состоянии образуют комплексы с двумя молекулами белка теплового шока.Образовавшийся комплекс гормона и рецептора перемещается в виде димера в ядро клетки, где связывается с коактивирующими молекулами: белком, связывающим циклический аденозинмонофосфат (цАМФ)-чувствительный элемент (СВР), коактиватор стероидного рецептора и др., а также с чувствительным элементом генов (геномный эффект действия ИГКС). СBP обладает свойствами ацетилтрансферазы и активирует ацетилирование гистонов, что приводит к уменьшению плотности хроматина и считыванию генетической информации. Таким путем в клетках активируются процессы синтеза белков, обладающих противовоспалительным эффектом: липокортина 1, секреторного ингибитора протеаз лейкоцитов, ингибитора ядерного фактора каппа В (NF-kB), интерлейкина 10,b2-адренорецепторов клеток легких и др.
В последние годы было установлено, что гормонорецепторные комплексы (в виде мономера) непосредственно и через молекулы СBP взаимодействуют с факторами транскрипции (активирующий протеин 1 (AP-1), NF-kB и др.). Активность последних в клетках возрастает под влиянием оксидантов, медиаторов воспаления и вирусов. Итогом этого является торможение транскрипции «воспалительных» генов (трансрепрессия), которое, в свою очередь, уменьшает образование в клетках следующих белков и пептидов: провоспалительных цитокинов (интерлейкинов 1, 2, 3, 4, 5, 6, 8, 11, 13, 16, 17, 18 и др.), индуцибельной синтазы оксида азота и циклооксигеназы, фосфолипазы А2, эндотелина-1, молекул адгезии (ICAM-1, VCAM-1, E-cелектина) лейкоцитов и др. Описанные механизмы составляют основу внегеномного действия ИГКС.
Относительно недавно было показано, что одним из молекулярных механизмов торможения экспрессии «воспалительных» генов со стороны ГКС является активация фермента деацетилазы. Деацетилирование гистонов хромосом приводит к уплотнению структуры хроматина и ограничению доступа к ДНК «воспалительных» факторов транскрипции.
Известные в настоящее время данные о геномном и внегеномном эффектах ИГКС суммированы на рис. 1.
![Рис. 1. Механизм действия ИГКС [1] Рис. 1. Механизм действия ИГКС [1]](/upload/medialibrary/d36/20-1.png)
Обсуждаемые выше молекулярные механизмы действия ИГКС определяют их влияние на различные клетки, представленные в дыхательных путях (табл. 1).
![Таблица 1. Влияние ИГКС на клетки дыхательных путей [1] Таблица 1. Влияние ИГКС на клетки дыхательных путей [1]](/upload/medialibrary/31b/20-2.png)
Механизмы взаимодействия игкс с другими лекарственными средствами
b2-адреномиметики длительного действия (ддба) и игкс
Установлено, что ИГКС и ДДБА (сальметерол, формотерол, вилантерол) обладают комплементарным действием и синергизмом. Эти препараты влияют на различные механизмы развития БА. Доказано, что ГКС повышают синтез b2-адренорецепторов, предупреждают развитие их десенситизации. В свою очередь, ДДБА фосфорилируют глюкокортикоидные рецепторы и повышают их чувствительность к агонистам. Они стимулируют перемещение комплексов «рецептор-стероид» в ядро и увеличивают время их нахождения в нем.Метаанализ клинических наблюдений показал, что использование комбинации ИГКС/ДДБА достоверно снижает выраженность симптомов, частоту обострений БА, улучшает качество жизни больных и уменьшает стоимость лечения по сравнению с монотерапией аналогичными и высокими дозами ИГКС у взрослых [3, 4]. На этой основе были созданы комбинированные препараты: салметерол/флутиказона пропионат, формотерол/будесонид, формотерол/беклометазона дипропионат, формотерол/мометазона фуроат, вилантерол/флутиказона фуроат, которые являются высокоэффективными средствами лечения БА.
Согласно международным и национальным рекомендациям, применение ДДБА без сопутствующих ИГКС при астме недопустимо [5, 6]. С учетом недостаточной дисциплины части пациентов предпочтительно использовать фиксированные комбинации, содержащие оба компонента в одной ингаляционной дозе (салметерол/флутиказона пропионат, формотерол/будесонид и пр.). Если пациент получает ИГКС и ДДБА раздельно (будесонид + формотерол), очень важно регулярно проверять, насколько четко он соблюдает предписанный режим применения препаратов.
Антилейкотриеновые препараты и игкс
Антилейкотриеновые препараты (АЛТП) усиливают действие ИГКС таким образом, что последние не оказывают существенного влияния на продукцию клетками цистеиниловых лейкотриенов. АЛТП снижают потребность в ИГКС у больных среднетяжелой и тяжелой БА, улучшают контроль заболевания при недостаточном эффекте монотерапии ИГКС. Тем не менее эффективность комбинации ИГКС/АЛТП ниже, чем комбинации ИГКС/ДДБА [7].Теофиллин и игкс
Установлено, что теофиллин в низких дозах обладает не только бронхорасширяющим, но и противовоспалительным эффектом. Считается, что один из механизмов действия этого препарата заключается в активации деацетилазы гистонов, приводящей к торможению транскрипции «воспалительных» генов. Установлено, что низкие дозы теофиллина повышают активность деацетилазы и соответственно уменьшается эозинофилия дыхательных путей. ГКС вызывают активацию этого же фермента и другим путем. Таким образом, теофиллин может усиливать противовоспалительную активность ИГКС. За счет этого, вероятно, можно объяснить увеличение их терапевтического эффекта при добавлении низких доз теофиллина у больных БА.Клиническая фармакология игкс
В клинической практике в различных странах мира используют беклометазона дипропионат (БДП), триамцинолона ацетонид, флунизолид, будесонид (БУД), флутиказона пропионат (ФП), мометазона фуроат (МФ), циклезонид (ЦИК), флутиказона фуроат (ФФ). Большинство этих препаратов имеют формы для ингаляционного (табл. 2) и интраназального введения.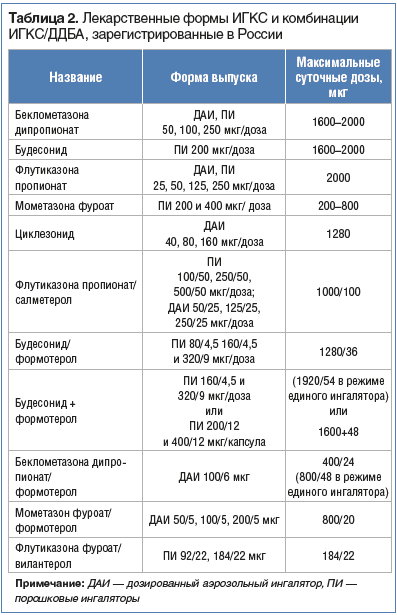
Фармакокинетика игкс
Системное действие ИГКС обусловлено их фракцией, поступающей в кровоток. Она складывается из количества, которое откладывается в полости рта, проглатывается и всасывается в желудке и кишечнике, а также из порции препарата, поступающей в кровь из легких. Важными характеристиками ИГКС являются следующие показатели: биодоступность при пероральном и ингаляционном приеме (количество, поступающее в системный кровоток, в процентах к введенной дозе), клиренс (скорость выведения стероида из крови в единицу времени), объем распределения (характеризует липофильность препарата) и период полувыведения из крови и легких (время, за которое концентрация ИГКС в организме уменьшается вдвое) (табл. 3). Эти показатели определяют терапевтический индекс ИГКС, т. е. соотношение их местной противовоспалительной активности и системного действия. Очевидно, что терапевтический индекс наиболее оптимален у тех соединений, которые длительно сохраняются в легких после ингаляции и полностью инактивируются при поступлении в кровь.![Таблица 3. Фармакокинетика ИГКС, зарегистрированных в России [8–11] Таблица 3. Фармакокинетика ИГКС, зарегистрированных в России [8–11]](/upload/medialibrary/990/20-4.png)
БДП — эталонный ИГКС. Используется в клинической практике с 1972 г. Это пролекарство, которое в легочной ткани быстро превращается в беклометазона 17-монопропионат (17-БМП). Абсолютная биодоступность БДП cоставляет 2%, биодоступность 17-БМП — 62%. Период его полувыведения (Т½) из крови — 0,5 часа, из легких — 0,1 часа. Поступивший в кровоток БДП превращается в печени в активный метаболит 17-БМП и неактивное соединение 21-БМП. Эффект первого прохождения препарата через гепатоциты составляет около 70%. Известно, что период полувыведения 17-БМП из легочной ткани равен 1,5–6,5 часа. Вероятно, это обусловлено его высокой липофильностью.
БУД является негалогенизированным ИГКС, состоящим из лево- и правовращающего изомеров. Он обладает высоким сродством к рецепторам. Его системная биодоступность составляет 11–13% при приеме per os и 26–38% (в зависимости от системы доставки) при ингаляциях. БУД быстро (примерно на 90%) метаболизируется в печени и выводится из кровотока в виде неактивных продуктов (Т½ — 1,7–3,4 часа) (см. табл. 3). Установлено, что в клетках препарат образует с жирными кислотами комплексы,
которые служат его внутриклеточными депо. Этим объясняется длительный противовоспалительный эффект БУД и возможность приема суточной дозы однократно.
ФП обладает низкой системной биодоступностью: при приеме per os — менее 1%, при ингаляциях — 5,3–17% (см. табл. 3). Эффект первого прохождения через печень высок (~99%). Эквивалентные терапевтические дозы ФП почти в 2 раза меньше, чем у БДП (табл. 4).
![Таблица 4. Эквивалентные дозы ИГКС, зарегистрированных в России [6] Таблица 4. Эквивалентные дозы ИГКС, зарегистрированных в России [6]](/upload/medialibrary/d44/20-5.png)
Отличительной характеристикой МФ является низкая биодоступность (<0,1% при проглатывании и 1–11% при ингаляциях). В печени препарат интенсивно метаболизируется цитохромом Р450 до полярных соединений и выводится с желчью и мочой.
ЦИК является негалогенизированным ИГКС, представляет собой пролекарство. Под влиянием эндогенных эстераз он превращается в клетках легочной ткани в активное соединение дезизобутирил-циклезонид. Локальная активация ЦИК усиливает его действие, снижает вероятность развития местных и системных побочных эффектов. ЦИК и его метаболит образуют обратимые комплексы с жирными кислотами, которые служат их депо в клетках. Это увеличивает продолжительность противовоспалительного эффекта препарата и объясняет возможность его однократного приема в сутки.
ФФ — это синтетический трифторированный ГКС с наиболее высокой аффинностью и селективностью к глюкокортикоидному рецептору среди всех существующих препаратов ГКС. Он представляет собой комбинацию молекулы флутиказона и 17-a фуроатного эфира, которые обеспечивают его основные свойства. Хотя ФФ структурно похож на ФП, они различаются химическими и фармакологическими свойствами. Ни один из препаратов не метаболизируется в печени до флутиказона. Они инактивируются ферментом CYP3A4 системы Р450 с преобразованием 17b-фторметилтиоэфирной группы и получением в итоге различных неактивных метаболитов. Абсолютная биодоступность ФФ низкая (см. табл. 3). Высокая аффинность к глюкокортикоидному рецептору и длительное персистирование в тканях объясняют высокий противовоспалительный потенциал ФФ, поэтому его можно принимать 1 раз в сутки.
В клинической практике используются низкие, средние и высокие дозы ИГКС (см. табл. 4). Эффективность эквивалентных доз различных препаратов примерно одинакова [6].
Большая часть терапевтических эффектов ИГКС наблюдается при их использовании в сравнительно низких дозах (БУД 400 мгк/сут или эквивалентные дозы других препаратов). Высокие дозы нередко вызывают побочные действия и не усиливают положительного эффекта. Это является обоснованием для назначения пациентам с БА комбинированной терапии при неэффективности низких и средних доз ИГКС.
Системы доставки ИГКС
К числу факторов, определяющих эффективность ИГКС и приверженность больных лечению, относятся системы их доставки. В качестве последних используются дозированные аэрозольные ингаляторы (ДАИ), ДАИ со спейсером, порошковые ингаляторы и небулайзеры. Современные порошковые ингаляторы по сравнению с ДАИ реже вызывают местные побочные эффекты (кандидоз и осиплость голоса). Это связано с уменьшением отложения ИГКС в полости рта.В настоящее время в клинической практике используются небулайзеры. ИГКС могут заменить таблетированные стероиды при лечении нетяжелых обострений БА. В некоторых исследованиях показано, что использование растворов ИГКС позволяет существенно уменьшить дозу пероральных ГКС у больных гормонозависимой БА. Небулайзерная терапия оказывается особенно полезной для больных, которые не могут правильно использовать другие дозирующие устройства. Высокая стоимость небулайзеров препятствует широкому их применению.
Клиническое применение игкс при ба
ИГКС эффективны у больных любого возраста при любой тяжести БА [5, 6, 12]. Они уменьшают выраженность всех клинических симптомов заболевания, повышают качество жизни пациентов, улучшают бронхиальную проходимость и снижают гиперреактивность бронхов. ИГКС предупреждают обострения БА и снижают частоту госпитализаций, уменьшают летальность при БА, предупреждают развитие ремоделирования дыхательных путей и способствуют его частичному обратному развитию при использовании в высоких дозах [5, 6].Установлено, что эффективность ИГКС при длительном лечении тем выше, чем раньше они назначены. В международных согласительных документах их рекомендуется использовать при легкой БА и при наличии симптомов в течение 2-х дней в неделю и более [6]. Вместе с тем в опубликованном недавно post-hoc анализе известного исследования START показано, что эффективность низких доз ИГКС не зависит от частоты симптомов легкой БА [13, 14].
Основные принципы назначения игкс при ба
Стартовая терапия при легкой и среднетяжелой БА в большинстве случаев предусматривает использование низких доз ИГКС (400 мкг/сут БДП или эквивалентной дозы других ИГКС) с последующим постепенным снижением до минимально необходимой дозы. При неконтролируемой БА и низких показателях функции легких возможно начало лечения с комбинации ИГКС и ДДБА.Лечение ИГКС должно быть длительным (не менее 3-х месяцев) и регулярным. Их преждевременная отмена сопровождается ухудшением течения БА. При достижении контроля БА снижение дозы должно быть постепенным — на 50% каждые 3 мес. до достижения минимальной эффективной дозы. При использовании низкой дозы ИГКС больного можно перевести на однократный прием препарата в день.
Кратность приема ИГКС при стабильном течении БА обычно 1 или 2 раза в день. При ухудшении контроля БА целесообразно рассмотреть увеличение дозы либо назначение комбинации ИГКС с препаратами других классов.
Комбинации ИГКС с ДДБА, антилейкотриеновыми препаратами или теофиллинами длительного действия по эффективности превосходят увеличенные дозы ИГКС. Наибольшей эффективностью обладает комбинация ИГКС/ДДБА. Основным показанием для ее назначения является недостаточная эффективность монотерапии низкими и средними дозами ИГКС.
При применении ИГКС возможно уменьшение дозы пероральных ГКС. По эффективности 400–600 мкг/сут БДП эквивалентны 5–10 мг преднизолона, при этом безопасность ИГКС значительно выше, чем у таблетированных ГКС. Клинический эффект отчетливо проявляется на 7–10-й день терапии ИГКС. При совместном применении дозу пероральных ГКС можно начинать снижать не ранее этого срока.
При обострении БА могут использоваться высокие дозы ИГКС (например, будесонид или БДП) через небулайзер.
Комлементарность действия и синергизм ИГКС и ДДБА, а также результаты клинических исследований явились основанием для создания комбинированных препаратов. В исследовании GOAL показано, что использование комбинации салметерол/флутиказон в течение 1 года позволяет добиться полного и хорошего контроля БА у большего числа больных, чем при использовании монотерапии ФП. Комбинированная терапия позволяла достичь более быстрого эффекта при использовании низких доз ФП [15]. Результаты этого исследования явились основой для разработки разных уровней контроля БА, нашедших отражение в международных рекомендациях [6].
С 2007 г. комбинация будесонид/формотерол, а позднее и комбинация БДП/формотерол зарегистрированы для лечения БА в режиме единого ингалятора, при котором один препарат назначается как для поддерживающей терапии, так и для купирования симптомов болезни. В клинических исследованиях показано, что при этом сокращается число обострений, улучшается контроль астмы и уменьшается поддерживающая доза ИГКС. В настоящее время терапия единым ингалятором используется для лечения БА у взрослых и детей с 12 лет.
Одним из направлений дальнейших исследований является оценка возможности использования интермиттирующего приема комбинации ИГКС с быстродействующим b2-адреномиметиком при легкой БА. Актуальность этого обусловлена невысокой (~25%) дисциплиной больных при использовании монотерапии ИГКС [16]. В настоящее время завершены клинические испытания комбинации будесонид/формотерол (SYGMA 1 и SYGMA 2), результаты которых позволят сделать вывод об эффективности и безопасности такого режима лечения.
Побочные эффекты игкс
Местные побочные эффекты свойственны всем известным ИГКС. Они зависят от дозы препаратов и вида дозирующего устройства.Ротоглоточный кандидоз. По разным данным, встречается у 5–25% больных. Проявляется жжением во рту и белесоватыми высыпаниями на слизистой оболочке. Частота его развития прямо пропорциональна дозе и кратности приема ИГКС. Для лечения используется сублингвальный прием нистатина.
Для профилактики кандидоза больным рекомендуют полоскание рта после каждой ингаляции. Снижает заболеваемость использование спейсера с ДАИ или порошковых ингаляторов, а также применение ИГКС в более низких дозах и с меньшей кратностью.
Кандидоз пищевода. Считалось, что кандидоз пищевода вследствие применения ИГКС встречается достаточно редко, но при использовании эндоскопических методов исследования частота этого побочного эффекта достигает 35–37%. Поэтому пациентам рекомендуется не ложиться сразу после ингаляции и применять препарат до завтрака и ужина, чтобы его частицы удалялись из пищевода с пассажем пищи.
Осиплость голоса (дисфония). Наблюдается в 30–58% случаев. Зависит от дозы ИГКС и вида дозирующего устройства. Обусловлена отложением препарата в гортани и развитием стероидной миопатии ее мышц. Нередко развивается у людей, профессия которых связана с повышенной голосовой нагрузкой (певцы, лекторы, педагоги, дикторы и др.). При лечении и профилактике дисфонии необходимо щадить голос, применять порошковые ингаляторы вместо ДАИ, а также использовать более низкие дозы ИГКС.
Раздражение верхних дыхательных путей. Проявляется кашлем и бронхоспазмом. Нередко обусловлено лактозой, содержащейся в порошковых ингаляторах, и пропеллентом — в ДАИ. Для профилактики и лечения этого осложнения перед использованием ИГКС назначают b2-агонисты быстрого действия и применяют спейсер.
Системные эффекты. Низкие и средние дозы ИГКС не вызывают развития системных эффектов. Появление последних возможно только при длительном использовании высоких доз любых ИГКС. Сведения о возможных побочных эффектах суммированы в таблице 5.

Таким образом, результаты клинических исследований не исключают потенциальной возможности развития побочных эффектов при лечении больных БА высокими дозами любых ИГКС. Однако их риск значительно ниже, чем при применении таблетированных ГКС.
Наиболее чувствительны к высоким дозам ИГКС люди пожилого возраста и пациенты, имеющие сопутствующие заболевания (сахарный диабет, болезни щитовидной железы, гипогонадизм), курильщики и лица, злоупотребляющие алкоголем, а также больные с ограниченной физической активностью. Динамическое наблюдение за пациентами группы риска должно включать: осмотр полости рта и глотки (для исключения грибкового поражения), офтальмоскопию и измерение внутриглазного давления, костную денситометрию (позвонки, шейка бедра) каждые 6–12 мес.
Для профилактики возможных системных побочных эффектов высоких доз ИГКС рекомендуются: ДАИ со спейсерами и порошковые ингаляторы; назначение витамина D3 и кальция; нормализация физической активности; отказ от вредных привычек (курение, употребление алкоголя); защита глаз от ультрафиолетового излучения (ношение темных очков, шляп).
Итак, ИГКС занимают ведущее место при лечении БА. Их своевременное назначение и рациональное использование являются залогом успешной терапии этого заболевания.
Литература
1. Barnes P. Corticosteroid effects on signaling cells // Eur Respir J. 2006. Vol. 27(2). P.413–426.
2. Barnes P.J. Scientific rationale for using single inhaler for asthma control // Eur Respir J. 2007. Vol. 29(3). P.587–595.
3. Pauwells R.A., Lodfahl C-G., Postma D. et al. Effect of inhaled formoterol and budesonide on exacerbations of asthma // N Engl J Med. 1997. Vol. 337(20). P.1412–1418.
4. Ducharme F.M., Ni Chroinin M., Greenstone I., Lasserson T.J. Addition of long-acting beta2-agonists to inhaled steroids versus higher dose inhaled steroids in adults and children with persistent asthma // Cochrane Database Syst Rev. 2010. Vol. 14(4). CD005533.
5. British guideline on management of asthma. A national clinical guideline. Revised 2016. Available at: http://www.brit-thoracic.org.uk.
6. Global Initiative for Аsthma. NHLB/WHO Workshop Report.-National Heart Lung Blood Institute. Publication number 02-3659. 2017. Available at: http www. ginasthma.org.
7. Chauhan B.F., Ducharme F.M. Addition to inhaled corticosteroid of long acting beta2-agonists versu antileukotriens for chronic asthma // Cochrane Database Syst Rev. 2014. Vol. 1. CD003137.
8. Derendorf H. Pharmacokinetic and pharmacodinamic properties of inhaled corticosteroids in relation to efficacy and safety // Respiratory Medicine. 1997. Vol. 91. P.22–28.
9. Kelly H.W. Establishing a therapeutic index for the inhaled corticosteroids: Part I. Pharmacokinetic/pharmacodinamic comparison of the inhaled steroids // J Allergy Clin Immunol. 1998. Vol. 102(4) P.36–51.
10. Asmanex Twisthaler (mometasone furoate anhydrous dry powder inhaler). Clinical Monograph. USA. 2002. 93 p.
11. Breo Ellipta. Highlights of prescitiption informaton. FDA. 2013. Available at http: www.fda.gov.
12. O’Byrne P.M., Barnes P.J., Rodriquez-Rosin R. et al. Low dose inhaled budesonide and formoterol in mild persistent Asthma. The OPTIMA Randomized Trial // Am J Respir Crit Care Med. 2001. Vol. 164. P.1392–1397.
13. Pauwels R., Pedersen S., Busse W.W. et al. Early intervention with budesonide in mild persistent asthma: a randomised,double-blind trial // Lancet. 2003. Vol. 361 (9363). P.1071–1076.
14. Reddel H.K., Busse W.W., Pedersen S. et al. Should recommendations about starting inhaled corticosteroid treatment for mild asthma be based on symptom frequency: a post-hoc efficacy analysis of the START study // Lancet. 2017. Vol. 389 (10065). P.157–166.
15. Bateman E.D., Boushley H.A., Bousquet J. et al. Can guideline-defined asthma control be achieved? The Gaining Optimal Asthma Control Study // Am J Respir Crit Care Med. 2004. Vol. 170. P.836–844.
16. Williams L.K., Peterson L.E., Wells K. et al. Quantifying the proportion of severe asthma exacerbation attributable to inhaled corticosteroid nonadherence // JACI. 2011. Vol. 128(6). P.1185–1191.
17. Irwin R.S., Richardson N.D. Side effects with inhaled corticosteroids // Chest. 2006. Vol. 130(1). P.41–53
2. Barnes P.J. Scientific rationale for using single inhaler for asthma control // Eur Respir J. 2007. Vol. 29(3). P.587–595.
3. Pauwells R.A., Lodfahl C-G., Postma D. et al. Effect of inhaled formoterol and budesonide on exacerbations of asthma // N Engl J Med. 1997. Vol. 337(20). P.1412–1418.
4. Ducharme F.M., Ni Chroinin M., Greenstone I., Lasserson T.J. Addition of long-acting beta2-agonists to inhaled steroids versus higher dose inhaled steroids in adults and children with persistent asthma // Cochrane Database Syst Rev. 2010. Vol. 14(4). CD005533.
5. British guideline on management of asthma. A national clinical guideline. Revised 2016. Available at: http://www.brit-thoracic.org.uk.
6. Global Initiative for Аsthma. NHLB/WHO Workshop Report.-National Heart Lung Blood Institute. Publication number 02-3659. 2017. Available at: http www. ginasthma.org.
7. Chauhan B.F., Ducharme F.M. Addition to inhaled corticosteroid of long acting beta2-agonists versu antileukotriens for chronic asthma // Cochrane Database Syst Rev. 2014. Vol. 1. CD003137.
8. Derendorf H. Pharmacokinetic and pharmacodinamic properties of inhaled corticosteroids in relation to efficacy and safety // Respiratory Medicine. 1997. Vol. 91. P.22–28.
9. Kelly H.W. Establishing a therapeutic index for the inhaled corticosteroids: Part I. Pharmacokinetic/pharmacodinamic comparison of the inhaled steroids // J Allergy Clin Immunol. 1998. Vol. 102(4) P.36–51.
10. Asmanex Twisthaler (mometasone furoate anhydrous dry powder inhaler). Clinical Monograph. USA. 2002. 93 p.
11. Breo Ellipta. Highlights of prescitiption informaton. FDA. 2013. Available at http: www.fda.gov.
12. O’Byrne P.M., Barnes P.J., Rodriquez-Rosin R. et al. Low dose inhaled budesonide and formoterol in mild persistent Asthma. The OPTIMA Randomized Trial // Am J Respir Crit Care Med. 2001. Vol. 164. P.1392–1397.
13. Pauwels R., Pedersen S., Busse W.W. et al. Early intervention with budesonide in mild persistent asthma: a randomised,double-blind trial // Lancet. 2003. Vol. 361 (9363). P.1071–1076.
14. Reddel H.K., Busse W.W., Pedersen S. et al. Should recommendations about starting inhaled corticosteroid treatment for mild asthma be based on symptom frequency: a post-hoc efficacy analysis of the START study // Lancet. 2017. Vol. 389 (10065). P.157–166.
15. Bateman E.D., Boushley H.A., Bousquet J. et al. Can guideline-defined asthma control be achieved? The Gaining Optimal Asthma Control Study // Am J Respir Crit Care Med. 2004. Vol. 170. P.836–844.
16. Williams L.K., Peterson L.E., Wells K. et al. Quantifying the proportion of severe asthma exacerbation attributable to inhaled corticosteroid nonadherence // JACI. 2011. Vol. 128(6). P.1185–1191.
17. Irwin R.S., Richardson N.D. Side effects with inhaled corticosteroids // Chest. 2006. Vol. 130(1). P.41–53

Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Предыдущая статья
Следующая статья
